明日と明後日は医学類の試験💦ですが、2024年最後のラボセミナーを行いました。寒さのためか、体調を崩す人が多いようです。機材の放熱で暖かく加湿器が設置されている快適な研究室でぜひ活動しましょう。本日は、M3のSさんが下記の論文を紹介、Hさんが研究進捗報告をしてくれました。M2の皆さんは、神経系の試験の準備状況はいかがでしょうか?
Cell. 2024 Apr 11;187(8):1936-1954.e24. doi: 10.1016/j.cell.2024.02.020. Epub 2024 Mar 14.
Type-I-interferon-responsive microglia shape cortical development and behavior (I型インターフェロン応答性ミクログリアが皮質発達と行動を形成する)
Caroline C Escoubas 1, Leah C Dorman 2, Phi T Nguyen 3, Christian Lagares-Linares 1, Haruna Nakajo 1, Sarah R Anderson 1, Jerika J Barron 3, Sarah D Wade 2, Beatriz Cuevas 2, Ilia D Vainchtein 1, Nicholas J Silva 1, Ricardo Guajardo 4, Yinghong Xiao 5, Peter V Lidsky 5, Ellen Y Wang 6, Brianna M Rivera 7, Sunrae E Taloma 2, Dong Kyu Kim 1, Elizaveta Kaminskaya 1, Hiromi Nakao-Inoue 1, Bjoern Schwer 8, Thomas D Arnold 9, Ari B Molofsky 10, Carlo Condello 11, Raul Andino 5, Tomasz J Nowakowski 12, Anna V Molofsky 13
Departments of Psychiatry and Behavioral Sciences/Weill Institute for Neurosciences, University of California, San Francisco, San Francisco, CA 94158, USA; Kavli Institute for Fundamental Neuroscience, University of California, San Francisco, San Francisco, CA 94158, USA; Eli and Edythe Broad Center for Regeneration Medicine and Stem Cell Research, University of California, San Francisco, San Francisco, CA 94158, USA.
Departments of Psychiatry and Behavioral SciencesおよびWeill Institute for Neurosciencesは、カリフォルニア大学サンフランシスコ校(UCSF)の精神医学と神経科学の最前線に位置する学術機関です。この部門と研究所は、精神疾患や行動障害の研究、教育、臨床治療を統合的に推進し、脳と心の健康に対する包括的なアプローチを提供しています。Weill Institute for Neurosciencesは2016年に設立され、Weill Family Foundationの支援を受けており、神経系疾患の研究、診断、治療を強化する目的で活動しています。
この研究所では、神経発達や脳の可塑性に関する基礎研究をはじめ、精神疾患の分子メカニズムの解明、新規治療法の開発など、さまざまな分野に焦点を当てています。対象となる疾患には、自閉症、統合失調症、うつ病、双極性障害などが含まれ、遺伝学的解析やバイオマーカーの発見を通じて、これらの疾患の理解を深めることを目指しています。また、脳と免疫系の相互作用を探る神経免疫学の研究や、神経疾患における診断と予後評価を改善する生物学的指標の発見にも注力しています。
教育面においては、精神科医、心理学者、研究者の育成に特化したプログラムを提供し、学部生からポスドク研究者まで幅広い層を対象としたトレーニングを行っています。UCSFの医療現場を活用した臨床実習は、理論と実践を融合させた教育体制を実現しており、精神疾患の診断と治療に関する高度な専門性を備えた人材を育成しています。
ハイライト
- I型インターフェロン(IFN-I)応答性ミクログリアは、発達期のストレス下で増加する
- IFN-I応答性ミクログリアの特徴は、脳の病理学的状態においても保存されている
- IFN-I応答性ミクログリアは、皮質発達中にニューロン全体を貪食する
- IFN-I欠損は、興奮性/抑制性の不均衡と触覚過敏を引き起こす
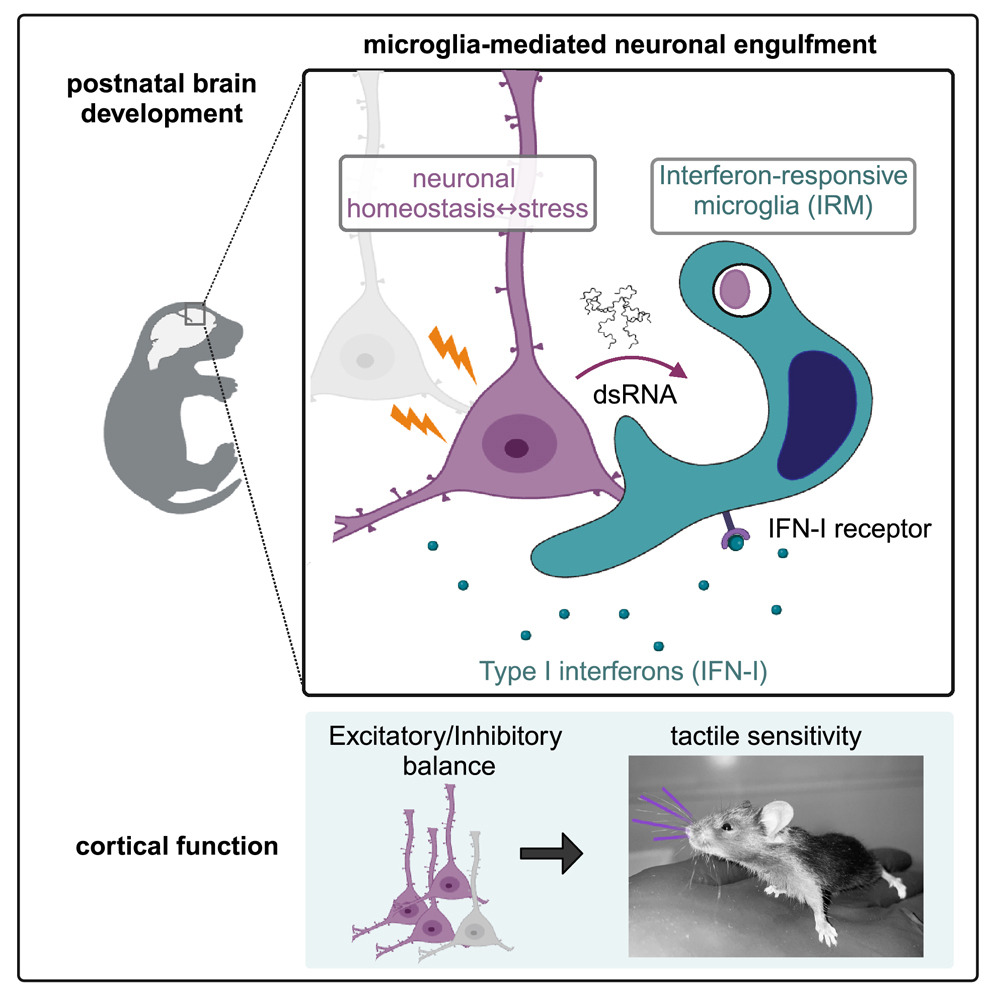
Summary
Microglia are brain-resident macrophages that shape neural circuit development and are implicated in neurodevelopmental diseases. Multiple microglial transcriptional states have been defined, but their functional significance is unclear. Here, we identify a type I interferon (IFN-I)-responsive microglial state in the developing somatosensory cortex (postnatal day 5) that is actively engulfing whole neurons. This population expands during cortical remodeling induced by partial whisker deprivation. Global or microglial-specific loss of the IFN-I receptor resulted in microglia with phagolysosomal dysfunction and an accumulation of neurons with nuclear DNA damage. IFN-I gain of function increased neuronal engulfment by microglia in both mouse and zebrafish and restricted the accumulation of DNA-damaged neurons. Finally, IFN-I deficiency resulted in excess cortical excitatory neurons and tactile hypersensitivity. These data define a role for neuron-engulfing microglia during a critical window of brain development and reveal homeostatic functions of a canonical antiviral signaling pathway in the brain.
背景
脳発達の間、神経回路は経験依存的な変化を受け、その過程のわずかな変化が自閉症やてんかん、統合失調症などの神経発達疾患と関連している。ミクログリアはシナプス形成や除去、神経活動の調節、さらにはニューロン全体の除去など多様な役割を持つが、それらの機能不全は神経発達疾患に関与する。本研究では、I型インターフェロン(IFN-I)応答性ミクログリア(IRMs)の役割を明らかにすることを目的とした。
方法
部分的なウィスカー(ヒゲ)除去モデルを用い、IFN-I応答性ミクログリアの特性を調査した。シングルセルRNAシーケンシング、免疫染色、蛍光in situ hybridization、ライブイメージング、遺伝子改変マウスモデルを使用して、IRMsの機能と神経発達における影響を解析した。また、ニューロンのDNA損傷やミクログリアの貪食活性をIFN-Iの有無で比較した。
結果
- IRMsの出現と増加:
- 正常な脳発達ではIFN-I応答性ミクログリア(IRMs)は稀であり、ミクログリア全体の0.5%未満を占めるが、部分的なウィスカー除去後に20倍増加した。これらのIRMsは主に皮質の第4層(L4)と第5層(L5)に位置していた。
- IRMsは、ニューロンを取り囲み、貪食性の構造を持つことが観察された。
- DNA損傷ニューロンの蓄積:
- IFN-I受容体(Ifnar1)を欠損したマウスでは、ミクログリアの貪食機能が障害され、DNA損傷(53BP1+)を持つニューロンが顕著に蓄積した。これらのニューロンは特にL5で多く見られた。
- DNA損傷ニューロンの増加は生後5日目(P5)にピークを迎え、その後減少した。
- IRMsの貪食活性:
- IRMsはニューロンを取り囲む「貪食カップ」を形成し、複数のニューロンを同時に取り込むことが確認された。これらのIRMsは、一般的なミクログリアよりも高いリソソーム活性を示した。
- IFN-I刺激(IFN-β注射)はIRMsの数を増加させ、ニューロンの貪食を加速した。
- 行動への影響:
- IFN-I欠損マウスでは、感覚過敏が顕著であり、ウィスカーニュイサンス試験で触覚刺激に対する回避行動が増加した。
- IFN-I応答の欠如は、抑制性ニューロン(パルブアルブミン+細胞)の減少と興奮性ニューロン(CTIP2+細胞)の増加に関連していた。これにより、皮質内での興奮性/抑制性のバランスが崩れた。
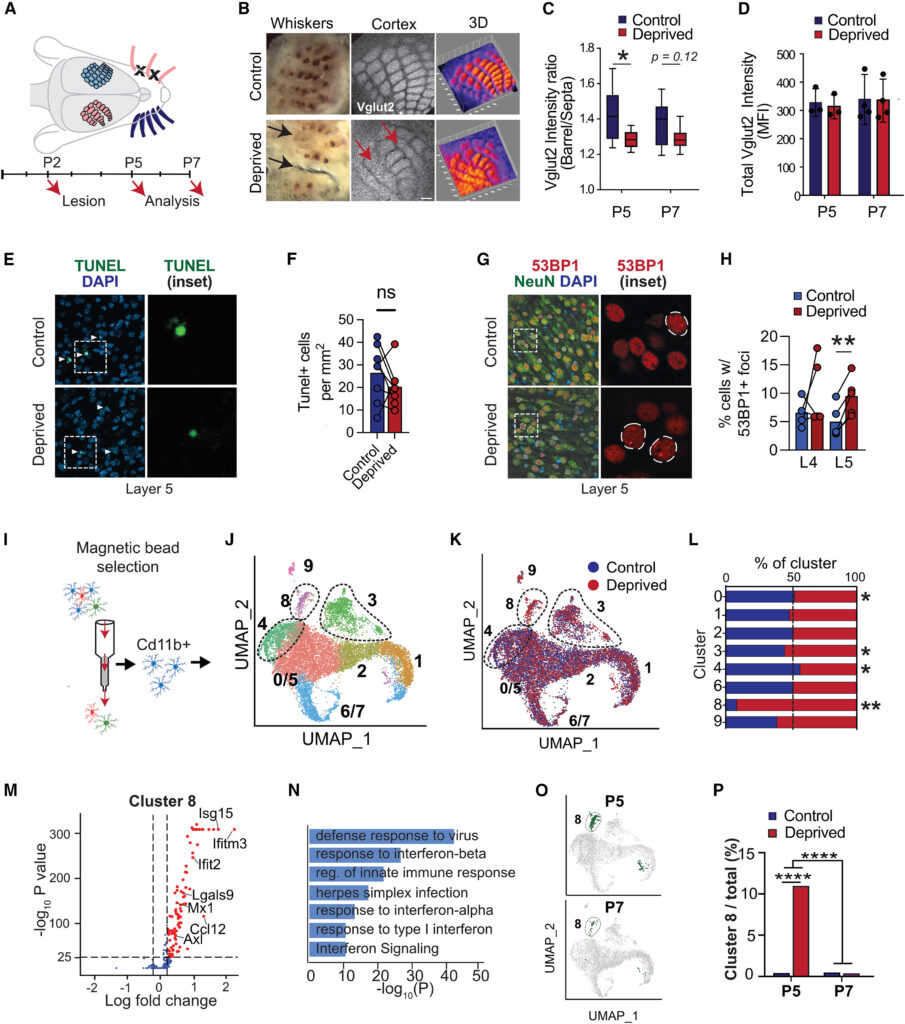
パネルCとDでは、VGLUT2の強度を用いてバレルとセプタムの区別度、および皮質全体のVGLUT2強度を比較しているが、バレル/セプタムの区別度が減少している一方で、皮質全体の強度には有意な変化が見られない。パネルEとFは、制御群および除去群におけるTUNEL陽性細胞(DNA損傷細胞)の画像と定量結果を示しており、除去による細胞死の変化は確認されない。一方で、パネルGとHは、除去群で53BP1陽性焦点(DNA損傷マーカー)を持つニューロンが増加していることを示している。
パネルIでは、シングルセルRNAシーケンシングに用いたミクログリアの分離プロセスを示している。パネルJからLでは、UMAPクラスタリングを用いてミクログリアの異なる状態を特定し、ウィスカー除去群でIFN-I応答性ミクログリア(クラスター8)が顕著に増加していることを報告している。パネルMとNでは、クラスター8における特徴的な遺伝子発現とGO解析の結果を示しており、IFN-I応答に関連する遺伝子が豊富に発現していることを示唆している。最後に、パネルOとPでは、時間経過(P5およびP7)および条件(制御群および除去群)ごとにクラスター8の変化を詳細に解析しており、除去群でP5における顕著な増加が確認されている。
これらの結果は、IFN-I応答性ミクログリアが皮質のトポグラフィックな再構築に応答して増加し、脳発達中の重要な役割を果たしていることを示している。特に、ウィスカー除去に伴う局所的な環境変化が、これらのミクログリアの状態変化を引き起こしている可能性を示唆している。
考察
- IRMsの役割:
- 本研究は、IRMsがニューロンの貪食を通じて皮質回路を調節する新たな役割を示している。IRMsは、一時的かつ状況依存的に存在し、皮質の構造的リモデリングやニューロン損傷の制限に重要である。
- IRMsは特定の時期に限定的に現れ、局所的なストレス(例: ウィスカー除去)に応答して増加することが示された。
- IFN-Iシグナルの意義:
- IFN-Iは、ミクログリアに対して細胞内シグナルを提供し、効率的な貪食活動を促進する。IFN-I欠如では、ミクログリアが「バブル」状の貪食構造を形成し、貪食プロセスが停滞した。
- IFN-Iは、DNA損傷を持つニューロンを選択的に除去することで、皮質の神経回路の健全性を維持する。これにより、過剰な神経興奮性を制限し、正常な感覚運動機能をサポートする。
- 病理学的および発達的影響:
- 本研究は、IFN-I応答の不均衡が神経発達疾患(例: 自閉症や統合失調症)および神経炎症性疾患に寄与する可能性を示唆している。特に、過剰なIFN-I応答が神経炎症や不適切なニューロン除去を引き起こす危険性がある。
- 一方で、IFN-I応答の不足は、DNA損傷ニューロンの蓄積を許し、神経回路の成熟を阻害する可能性がある。
- IRMsの活性化メカニズムや、ニューロン選択の基準をさらに解明する必要がある。特に、ニューロンが損傷を受けるタイミングや程度に応じたIRMsの応答を研究することが重要である。
- IFN-I応答の調節が、神経疾患の予防や治療において有望なターゲットとなる可能性がある。
本研究は、IRMsがニューロンの除去を通じて皮質発達と感覚運動機能に重要な役割を果たしていることを示す。また、IFN-I応答がニューロンの損傷や過剰な興奮を制限することで、皮質の健全な構造と機能を維持するメカニズムを提案している。IFN-Iは、発達期における神経疾患(自閉症や統合失調症など)の治療ターゲットとしての可能性がある。またミクログリアやIFN-I応答の調節を通じた神経発達障害の予防や治療につながりうる。




運は天にあり、鎧は胸にあり、手柄は足にあり、 何時も敵を掌中に入れて合戦すべし。 死なんと戦えば生き、 生きんと戦えば必ず死するものなり。 運は一定にあらず、 時の次第と思うは間違いなり。 武士なれば、わが進むべき道はこれほかなしと、 自らに運を定めるべし。(上杉謙信)