Journal of Neuroinflammation volume 21, Article number: 233 (2024)
Repeated LPS induces training and tolerance of microglial responses across brain regions (反復的なLPS投与により、脳領域全体でミクログリアの反応が訓練され、寛容性が誘導される)
Jennifer Kim 1 2, Olivia Sullivan 1 2, Kristen Lee 2, Justin Jao 2, Juan Tamayo 3, Abdullah Muhammad Madany 3, Brandon Wong 2, Paul Ashwood 3, Annie Vogel Ciernia 4 5 6
- Graduate Program in Neuroscience, University of British Columbia, Vancouver, Canada
- Department of Biochemistry and Molecular Biology, University of British Columbia, Vancouver, Canada
- Djavad Mowafaghian Centre for Brain Health, Vancouver, Canada
ブリティッシュコロンビア大学(略称:UBC)は、カナダ・ブリティッシュコロンビア州が設置した公立大学である。バンクーバー市西端に所在する研究総合大学である。1908年創立。カナダ屈指の名門大学。1908年にマギル大学の分校として設立された。
Abstract
Background
Neuroinflammation is involved in the pathogenesis of almost every central nervous system disorder. As the brain’s innate immune cells, microglia fine tune their activity to a dynamic brain environment. Previous studies have shown that repeated bouts of peripheral inflammation can trigger long-term changes in microglial gene expression and function, a form of innate immune memory.
Methods and results
In this study, we used multiple low-dose lipopolysaccharide (LPS) injections in adult mice to study the acute cytokine, transcriptomic, and microglia morphological changes that contribute to the formation of immune memory in the frontal cortex, hippocampus, and striatum, as well as the long-term effects of these changes on behavior. Training and tolerance of gene expression was shared across regions, and we identified 3 unique clusters of DEGs (2xLPS-sensitive, 4xLPS-sensitive, LPS-decreased) enriched for different biological functions. 2xLPS-sensitive DEG promoters were enriched for binding sites for IRF and NFkB family transcription factors, two key regulators of innate immune memory. We quantified shifts in microglia morphological populations and found that while the proportion of ramified and rod-like microglia mostly remained consistent within brain regions and sexes with LPS treatment, there was a shift from ameboid towards hypertrophic morphological states across immune memory states and a dynamic emergence and resolution of events of microglia aligning end-to-end with repeated LPS.
Conclusions
Together, findings support the dynamic regulation of microglia during the formation of immune memories in the brain and support future work to exploit this model in brain disease contexts.
本研究では、成人マウスにおいて低用量のリポポリサッカライド (LPS) の複数回の注射が、前頭皮質、海馬、線条体のミクログリアの急性なサイトカイン、トランスクリプトーム、および形態学的変化をどのように誘発し、免疫記憶の形成に寄与するかを探求した。LPSの訓練および寛容性の遺伝子発現パターンは複数の脳領域で共有されており、2xLPS感受性、4xLPS感受性、LPS減少の3つの異なる遺伝子クラスターが特定された。これらはIRFおよびNFkBファミリーの転写因子によるプロモーター領域の結合部位の濃縮と関連していた。ミクログリアの形態変化は領域間で共通し、一部はアメーバ型から肥大型への移行が見られた。結果は、脳の免疫記憶の形成におけるミクログリアの動的な調整を支持している。
Background
神経炎症は中枢神経系疾患の多くの病因に関与している。ミクログリアは脳の免疫細胞として、炎症への迅速な反応や、シナプスの調整といった脳の恒常性維持の役割を担う。過去の炎症がミクログリアに長期的な遺伝子発現や機能変化を引き起こし、免疫記憶と呼ばれる現象を形成する。
Methods
この研究では、C57BL/6J系統の成体オスおよびメスのマウス (10–18週齢) に、0.5 mg/kg のLPS(リポポリサッカライド)を腹腔内注射して、免疫応答とミクログリアの変化を評価した。注射は毎日午前9時から10時の間に4日間連続で行い、実験群は以下のように分けた。
- PBS対照群
- 1xLPS群(4日目のみLPS)
- 2xLPS群(3、4日目にLPS)
- 3xLPS群(2、3、4日目にLPS、オスのみ)
- 4xLPS群(全日LPS)
注射後3時間でマウスを安楽死させ、前頭皮質、海馬、線条体などの脳領域を採取し、RNAシーケンス(RNA-seq)とサイトカイン解析を行った。形態学的変化の評価は免疫組織化学とRT-qPCRで実施した。マウスの行動実験は注射から5日後の回復期間を経て開始し、不安様行動や記憶・学習に関する課題を含む行動バッテリーを用いた。
Results
LPS注射は、複数の脳領域で共有される遺伝子発現パターンを引き起こし、2xLPS感受性(226遺伝子)、4xLPS感受性(120遺伝子)、LPS減少(86遺伝子)の3つの主要なクラスターを特定した。IRFおよびNFkBファミリーの転写因子がこれらのクラスターのプロモーターに結合していることが分かり、免疫記憶の形成において重要な役割を果たしていることが示唆された。形態学的に、ミクログリアはアメーバ型から肥大型へのシフトを示し、特に訓練された免疫記憶状態での動的な変化が観察された。また、LPS注射後のサイトカインプロファイルは前頭皮質、海馬、線条体で急性の炎症反応を示し、部位ごとに異なる免疫応答が存在することが確認された。
行動実験の結果、LPS注射群はPBS群と比較して、不安様行動、反復行動、学習・記憶、抑うつ様行動において有意な長期的変化は見られなかった。ただし、LPS注射後3時間の急性期には症状の変化が確認された。
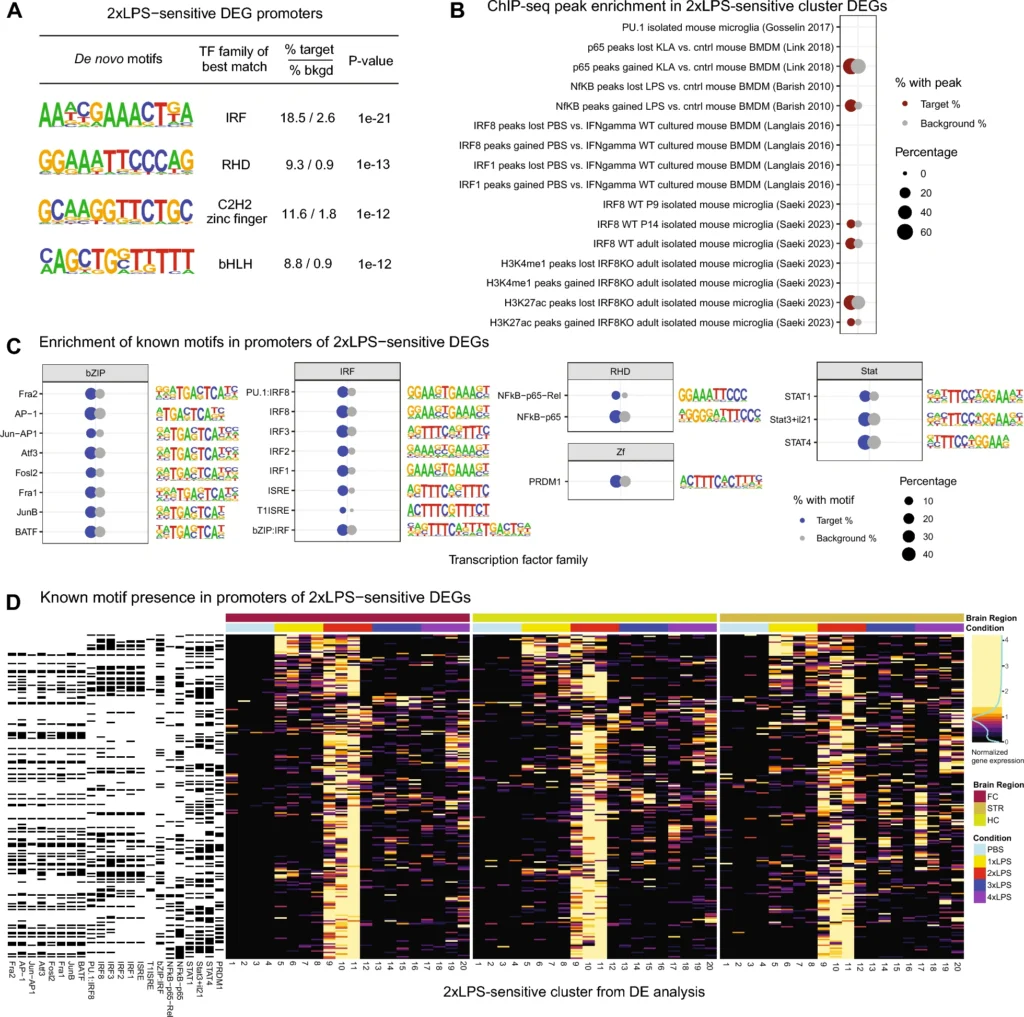
図4A:2xLPS感受性のDEGs(Differentially Expressed Genes)のプロモーター領域(転写開始サイトから+1000〜-200塩基対)における転写因子モチーフのde novo濃縮解析。主要なde novoモチーフ(例:IRFファミリー、RHD、C2H2ジンクフィンガー、bHLH/bZIP)が示され、p値が1e-10未満のものが強調されている。
図4B:公的なChIP-seqデータを使用して、マイクログリアや骨髄由来マクロファージ(BMDM)における2xLPS感受性DEGsのプロモーターへの転写因子の結合の濃縮が評価されている。赤い円は、RNA-seq実験内でChIP-seqピークを持つすべての遺伝子の背景と比較して、特定の転写因子が結合するDEGの有意な増加を示す(p < 0.05, BH補正済み)。
図4C:既知の転写因子モチーフの濃縮を示し、青い円がDEGsのプロモーターにそのモチーフを含む割合の有意な増加を示す。トップランクのモチーフは、BH補正済みのp値が0.05未満で表示されている。
図4D:2xLPS感受性DEGsのスケール化された遺伝子発現ヒートマップで、プロモーターに既知の転写因子モチーフが存在するかを黒(存在する)または白(存在しない)で示している。
これらの結果は、IRFおよびNFkBファミリーの転写因子が、2xLPS感受性の遺伝子発現の調節において重要な役割を果たしていることを支持する。
Discussion
この研究の結果は、LPSによる反復的な炎症刺激が脳のミクログリアにおける訓練と寛容性を引き起こすことを示している。複数の脳領域で観察された遺伝子発現のパターンは、炎症記憶の形成における共通性と部位特異的な調整を強調している。IRFおよびNFkBファミリーのプロモーター結合の発見は、ミクログリアが免疫記憶を形成し、異なる刺激に応じた応答を再プログラムする仕組みに関する新しい知見を提供する。さらに、アメーバ型から肥大型への形態学的シフトは、ミクログリアの機能的役割の動的調整を示しており、神経炎症のメカニズム理解に貢献する。この研究は、ミクログリアの動的な免疫応答が脳疾患における病理学的炎症にどのように影響するかを明らかにする将来の研究の基礎となり、アルツハイマー病や神経障害の治療戦略の開発に役立つ可能性がある。
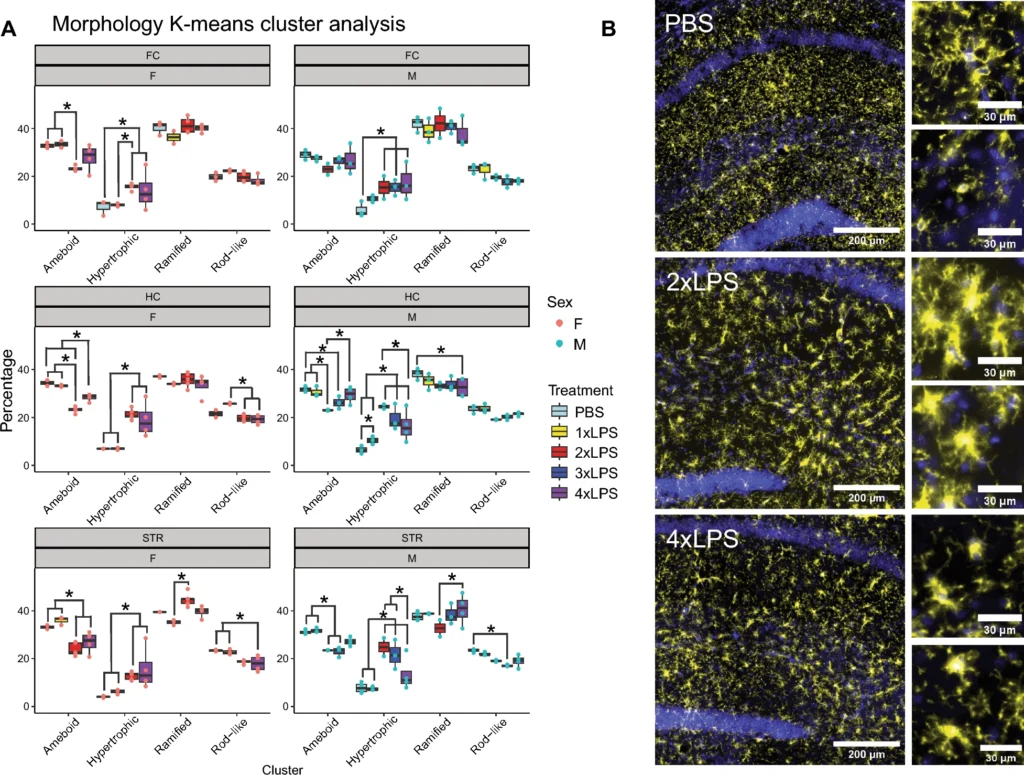
図5Aは、ミクログリアの形態がアメーバ型から肥大型への移行を示している。LPS処理後の免疫記憶形成と免疫寛容時に、脳の異なる領域と性別ごとに形態的変化が解析された。この図は、各領域(前頭皮質、海馬、線条体)において、アメーバ型と肥大型状態の割合が示され、特に2回のLPS処理(2xLPS)後に顕著な変化が観察されている。免疫寛容時(4xLPS)には、形態が再び元に戻る傾向が見られた。男性マウスでは、前頭皮質での肥大型の維持が示され、女性マウスでは前頭皮質、海馬、線条体で肥大型が持続した【14:0†source】 。
図5Bでは、ヒト脳の海馬におけるミクログリアの免疫蛍光染色例が示されている。PBS、2xLPS、および4xLPS条件下での染色が示され、ミクログリアは黄色でP2ry12抗体により染色され、核はDAPI(青色)で染色されている。スケールバーは200μmおよび30μmである。この図は、ミクログリアの形態変化を視覚的に確認するためのものであり、脳内でのLPS応答の影響を示している。
