Science. 2024 Oct 11;386(6718):217-224. doi: 10.1126/science.adq1456. Epub 2024 Oct 10.
Somatic mosaicism in schizophrenia brains reveals prenatal mutational processes (統合失調症脳における体細胞モザイク現象は出生前の変異プロセスを示す)
Eduardo A Maury # 1 2 3, Attila Jones # 4 5, Vladimir Seplyarskiy # 6 7, Thanh Thanh L Nguyen 8 9, Chaggai Rosenbluh 4, Taejong Bae 10, Yifan Wang 10, Alexej Abyzov 10, Sattar Khoshkhoo 1 3 11, Yasmine Chahine 1 3, Sijing Zhao 1, Sanan Venkatesh 5, Elise Root 8, Georgios Voloudakis 12, Panagiotis Roussos 12; Brain Somatic Mosaicism Network‡; Peter J Park 6, Schahram Akbarian 13 14, Kristen Brennand 8 9, Steven Reilly 8, Eunjung A Lee 1 3, Shamil R Sunyaev 6 7, Christopher A Walsh 1 3 15 16, Andrew Chess 4 5 14
- 1Division of Genetics and Genomics, Manton Center for Orphan Disease, Boston Children’s Hospital, Boston, MA 02115, USA.
- 2Bioinformatics and Integrative Genomics Program and Harvard/MIT MD-PHD Program, Harvard Medical School, Boston, MA 02115, USA.
ボストン小児病院(Children’s Hospital Boston)は、マサチューセッツ州ボストン、ロングウッドのメディカル・アカデミックエリアに位置する小児専門病院である。ハーバード・メディカルスクールの関連医療機関である。
Abstract
Germline mutations modulate the risk of developing schizophrenia (SCZ). Much less is known about the role of mosaic somatic mutations in the context of SCZ. Deep (239×) whole-genome sequencing (WGS) of brain neurons from 61 SCZ cases and 25 controls postmortem identified mutations occurring during prenatal neurogenesis. SCZ cases showed increased somatic variants in open chromatin, with increased mosaic CpG transversions (CpG>GpG) and T>G mutations at transcription factor binding sites (TFBSs) overlapping open chromatin, a result not seen in controls. Some of these variants alter gene expression, including SCZ risk genes and genes involved in neurodevelopment. Although these mutational processes can reflect a difference in factors indirectly involved in disease, increased somatic mutations at developmental TFBSs could also potentially contribute to SCZ.
編集者による要約
脳の発達中の体細胞変異は、いくつかの神経疾患と関連している。Maury et al.は、統合失調症(SZ)と診断されたドナーの後部前頭前皮質の組織で、詳細な全ゲノムシークエンシングを行い、神経発生の終了前に生じたと推定される体細胞変異を特定した(AnとKimによる展望を参照)。その結果、健常者の組織と比較して、SZ組織では転写因子結合部位の近傍における体細胞の単一ヌクレオチドバリアントの発生率が高いことが示された。これらのバリアントの一部は、既知のSZリスク遺伝子に関連していることから、神経発生期における体細胞変異が、後にSZを発症するリスクの全体的な決定に寄与している可能性が示唆される。 —Mattia Maroso
要約
生殖細胞変異は統合失調症(SCZ)を発症するリスクを変化させる。SCZとの関連においてモザイク体細胞変異の役割については、ほとんど知られていない。61人の統合失調症患者と25人の対照者の死後脳から採取した脳神経細胞の239倍の深度の全ゲノムシーケンス(WGS)により、胎児期の神経発生中に生じた突然変異が特定された。統合失調症患者では、クロマチンが開いた状態の体細胞変異が増加しており、クロマチンが開いた状態と重複する転写因子結合部位(TFBS)におけるモザイクCpGトランスバージョン(CpG>GpG)とT>G変異が増加していた。これは対照者では見られない結果であった。これらの変異体の一部は、SCZのリスク遺伝子や神経発達に関与する遺伝子など、遺伝子発現を変化させる。これらの変異プロセスは、疾患に間接的に関与する因子の差異を反映している可能性があるが、神経発達に関与する転写因子結合部位における体細胞変異の増加も、SCZの一因となっている可能性がある。
Methods
SCZ患者61名と対照25名の死後脳から、NeuN+ニューロンのDNAを抽出し、全ゲノムシーケンシングを行った。解析では、出生前の神経発生中に発生した体細胞変異に焦点を当て、SCZ患者と対照群での変異数やその分布を比較した。
Results (結果):
統合失調症(SCZ)患者と対照群の脳からニューロンDNAを解析した結果、SCZ患者では体細胞変異(sSNV)の頻度が高いことが確認された。SCZ患者の脳では、特に開いたクロマチン領域における変異が顕著であり、CpG部位での転座(CpG>GpG)やT>Gの変異が多く観察された。これらの変異は、主に転写因子結合部位(TFBS)に集中しており、SCZに関連する遺伝子や神経発達に関わる遺伝子の発現に影響を及ぼす可能性があることが示唆された。また、あるSCZ患者のサンプルでは、188の変異が検出されたが、このサンプルは統計に影響を与える可能性があるため、後続の解析からは除外された。全体として、SCZ患者の脳における変異は統計的に有意ではなかったが(p=0.051)、解析の結果、SCZ患者でより高い体細胞変異負荷が見られる傾向があった。
さらに、SCZ患者におけるsSNVの分布を詳細に解析したところ、胎児期脳の脱酸素ヌクレアーゼ(DNase)感受性サイト、つまり開いたクロマチン領域で変異率が増加していることが判明した(p=0.0015)。一方、H3K27me3領域(抑制クロマチン)では、変異率が低下していた(p=0.0004)。また、SCZ患者の転写因子結合部位(TFBS)周辺、特にTFBSの中心から±1kbの範囲でsSNVの増加が顕著であり(p=0.018)、その中でもCpG>GpG転座やT>Gの変異が特に多かった。これらの変異は、GRN遺伝子(前頭側頭葉変性に関連する遺伝子)など重要な遺伝子のプロモーター近傍で見つかっており、これがSCZの病態に影響を与える可能性がある。
さらに、T>G変異に関しては、SCZ患者の間で同じ遺伝子座で複数回再発する現象(同一部位同一変異、SVSS)が確認された。この現象は統計的に非常に稀なものであり(p=1.22 × 10^-11)、これによりSCZにおける特定の変異の蓄積プロセスが示唆された。T>G変異の再発は、DNA修復機構の阻害や酸化ストレスが関与している可能性がある。
Discussion (考察):
本研究では、統合失調症(SCZ)患者の脳における体細胞変異(sSNV)の分布と発生メカニズムを初めて詳細に解析した。結果として、SCZ患者において特に開いたクロマチン領域や転写因子結合部位(TFBS)での変異が顕著であることが示された。これらの変異は、神経発達の初期段階において発生し、出生前の特定の発生プロセスがSCZの病態形成に重要な役割を果たしている可能性を示唆している。特に、CpG>GpG転座やT>G変異はDNA修復機構の阻害や転写因子の結合による干渉が原因であり、これがSCZ患者の脳における体細胞変異の蓄積に繋がっていると考えられる。
また、同一部位同一変異(SVSS)がSCZ患者で複数回確認されたことは、特定のゲノム領域における変異のホットスポットが存在する可能性を示している。このホットスポットは、転写因子が結合している領域においてDNA修復機構が阻害され、変異が集中的に発生するメカニズムによって説明される可能性がある。類似の現象は癌細胞でも確認されており、SCZにおける変異メカニズムと癌におけるメカニズムが共通している可能性が考えられる。
本研究の結果は、SCZ患者における体細胞変異の蓄積が病態形成に寄与していることを示唆しており、特に胎児期の脳発達過程におけるDNA修復の障害がSCZリスクに関連している可能性が高い。しかし、サンプルサイズの限界や解析対象の制約により、今後の研究ではより大規模な解析が必要である。また、これらの変異が実際にどのようにSCZの症状や病態に影響を与えるのかを解明するためには、さらなる機能的な研究が必要である。本研究で得られた知見は、統合失調症の早期診断や予防的介入に役立つ可能性があり、特に出生前の神経発達異常の検出や治療法の開発に貢献する可能性がある。
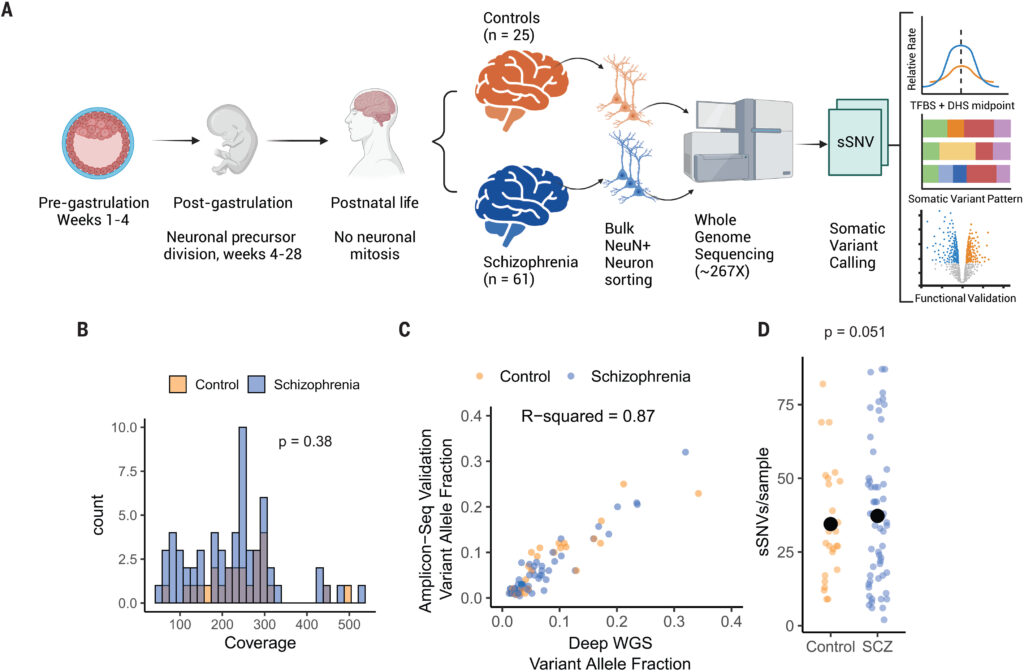
Figure 1: 統合失調症脳における実験デザインと体細胞変異の検証
図1aは、実験と解析の全体的なデザインを示している。出生前の脳発生過程で生じたクローン性体細胞変異がニューロン間で共有されることを示してい
る。この変異は、器官形成(器官発生以前の段階)や神経発生の間に発生し、複数の組織にわたって変異が存在することを意味している。出生後にニューロンで発生した変異はクローン性ではないため、この解析方法では検出できない。
図1bは、統合失調症患者群と対照群のサンプルにおけるシーケンスの平均カバレッジのヒストグラムを示している。統合失調症群と対照群のカバレッジには有意な差がないことが確認されており、これにより技術的なバイアスのないシーケンスデータが取得されていることがわかる(p=0.38)。
図1cは、検証用に選ばれた変異における深度全ゲノムシーケンス(WGS)とアンプリコンシーケンスによる変異アリル頻度(VAF)の散布図を示している。検証された変異は96のうち90であり(94%)、変異アリル頻度はWGSの推定値と高い相関を示している(R²=0.87)。また、統合失調症群と対照群の間で検証の成功率に有意差はない(p=0.66)。
図1dは、統合失調症群と対照群の各サンプルにおける体細胞変異数(sSNV)の分布を示している。188の変異を持つ統合失調症群の1つのサンプルが除外された後、統合失調症患者のサンプルあたりのsSNVは平均37.3であり、対照群では34.5であったが、この差は統計的に有意ではなかった(p=0.051)。
「理解とは許しである」(Tout comprendre c’est tout pardonner)ヴォルテール(Voltaire)