bioRxiv (2024年)
Microglia replacement by ER-Hoxb8 conditionally immortalized macrophages provides insight into Aicardi-Goutières Syndrome neuropathology
ER-Hoxb8条件的に不死化されたマクロファージによるミクログリアの置換がアイカルディ・グティエール症候群の神経病理に関する洞察を提供する
Kelsey M. Nemec, F. Chris Bennett et al.
Department of Psychiatry, Perelman School of Medicine, University of Pennsylvania, Philadelphia, PA, USA
Abstract
本研究では、ER-Hoxb8条件付き不死化マクロファージを用いたミクログリア置換が、アイカルディ・グティエール症候群(AGS)の神経病理を理解するための有効なモデルであることを示している。このER-Hoxb8マクロファージは、骨髄由来マクロファージと高度に類似しており、ミクログリアを欠く脳に移植された場合、脳実質に定着し、ミクログリア様の細胞に分化する。また、これらの細胞はウイルスで容易に遺伝子操作が可能で、安定した細胞株として保存できる。本研究では、CRISPR-Cas9を用いて、アイカルディ・グティエール症候群の原因となるAdar1遺伝子変異を持つER-Hoxb8細胞株を作成し、この変異がマクロファージのインターフェロン分泌と脳内定着に与える影響を調査した。その結果、Adar1ノックアウトは、インターフェロン分泌の増加とマクロファージ産生の障害を引き起こし、脳内マクロファージの定着を阻害することが明らかになった。この現象は、Ifih1(MDA5)変異の同時導入により、in vitroでは救済されたが、in vivoでは救済されなかった。さらに、患者特有のAdar1変異(D1113H)を持つER-Hoxb8細胞株を作成し、これらの変異が脳内でインターフェロン分泌を引き起こすことを示した。この結果は、ミクログリアがアイカルディ・グティエール症候群の神経病理に重要な役割を果たしていることを示唆している。
Background
ミクログリアは脳と脊髄の実質組織に常在するマクロファージであり、発達、恒常性、損傷、疾患において重要な役割を果たしている。内因性ミクログリアが枯渇すると、脳実質は代理マクロファージによって再構成されることが可能で、この過程は「ミクログリア置換」と呼ばれている。ミクログリア置換は、治療物質を標的部位に精密に投与したり、機能不全を補正するための新たな治療法としての可能性を持っている。しかし、一次ミクログリアの操作は非常に困難であり、迅速に転写アイデンティティを失うことや、ウイルス操作に対して抵抗性があることなどの制約があるため、新しい移植可能な細胞モデルが求められている。
Methods
ER-Hoxb8システムを使用して、骨髄由来のマクロファージを不死化し、それらの細胞を用いてミクログリア置換のモデルを作成した。このシステムにより、マクロファージ前駆細胞が無制限に増殖できるだけでなく、エストロゲンの除去によって分化することが可能である。さらに、CRISPR-Cas9技術を用いてAdar1変異を導入し、in vitroおよびin vivoでこの変異がマクロファージに及ぼす影響を調査した。
Results
- ER-Hoxb8マクロファージの骨髄由来マクロファージとの比較:
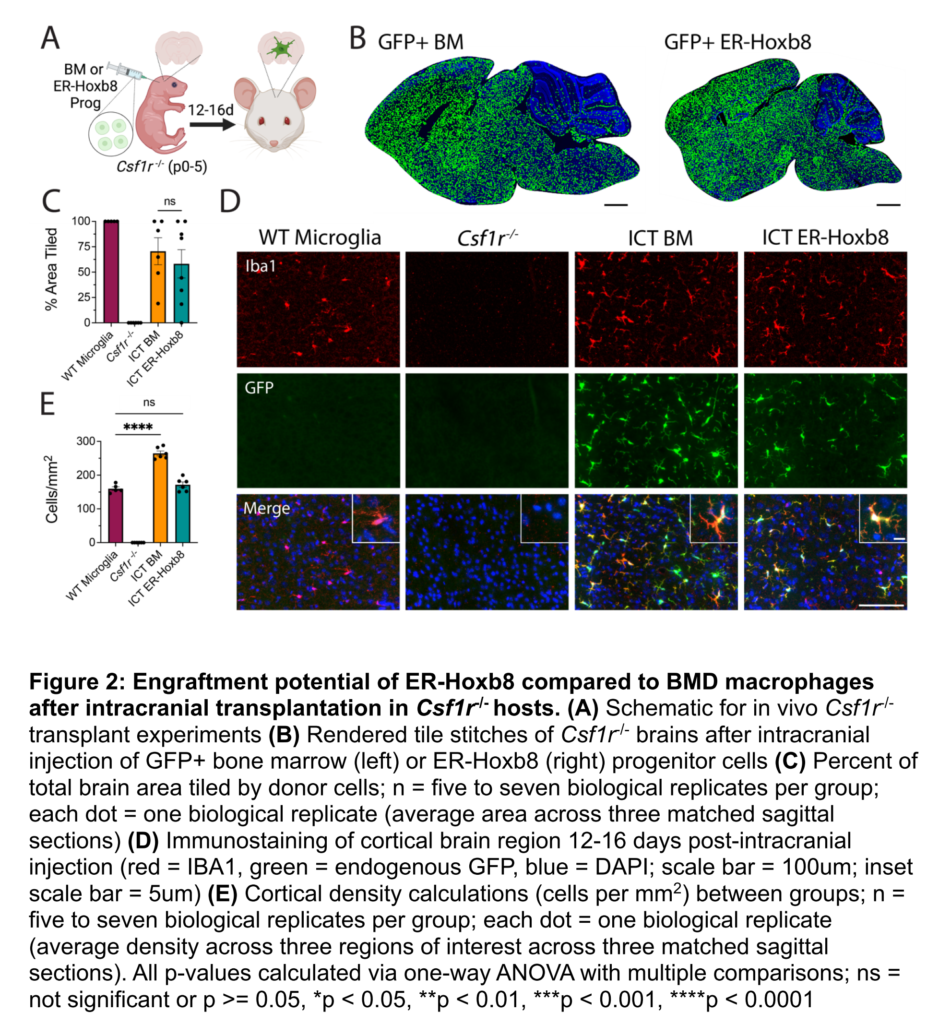
ER-Hoxb8マクロファージは、形態や遺伝子発現パターンにおいて骨髄由来マクロファージと非常に類似しており、RNAシーケンシングにおいても高い相関関係(R² = 0.96)が認められた。約85種類の遺伝子が差異を示したが、それらの遺伝子は主要な機能的な違いを示さなかった。 - 脳内でのER-Hoxb8細胞の定着:
Csf1r-/-ホストマウスに移植されたER-Hoxb8マクロファージは、ミクログリア様細胞に分化し、野生型ミクログリアと同等の密度で脳実質に定着した。移植後、これらの細胞はミクログリア特有の遺伝子を発現し始め、主要なミクログリアマーカーであるTMEM119の発現が確認された。 - Adar1ノックアウトとAGS病理:
Adar1遺伝子をノックアウトしたER-Hoxb8細胞では、インターフェロン応答の増加とマクロファージ産生の減少が確認された。また、バーシチニブという薬剤を用いることで、インターフェロン応答を抑制し、マクロファージの産生を回復させることができた。 - D1113H変異の影響:
患者特異的なAdar1変異(D1113H)を持つER-Hoxb8細胞を移植したところ、脳内でインターフェロン分泌が観察され、ミクログリアがAGS病理に寄与している可能性が示唆された。
Discussion
本研究は、ER-Hoxb8マクロファージがミクログリア置換の強力なモデルであり、特に遺伝子変異による神経疾患の研究において非常に有用であることを示している。Adar1変異がミクログリアに与える影響をin vitroおよびin vivoで明らかにし、AGSの病理学的メカニズムの理解に貢献している。また、将来的には治療応用への展開が期待されている。従来のミクログリア置換モデルとは異なり、ER-Hoxb8システムは、無制限の細胞増殖と容易な遺伝子操作を可能にし、ミクログリアの特定の遺伝子機能を迅速に検証できる新しいツールである。さらに、Adar1変異を持つマクロファージがAGS病理において果たす役割を明確にしている。ER-Hoxb8マクロファージは、完全なミクログリアのアイデンティティを持つわけではなく、特にSall1遺伝子の発現が欠如している。また、移植後の炎症関連遺伝子の発現がやや高くなることが観察されており、実験デザインにおいて考慮すべき点である。
ER-Hoxb8システムは、ミクログリアの研究ツールとして、また遺伝子編集や治療応用の開発において、強力なプラットフォームを提供している。特に、AGSやその他の神経疾患の治療法の開発に向けた応用が期待されている。