Molecular Neurobiology. 2024 Aug 19. doi: 10.1007/s12035-024-04404-0. Online ahead of print.
Published: 19 August 2024
Downregulation of Fidgetin-Like 2 Increases Microglial Function: The Relationship Between Microtubules, Morphology, and Activity (Fidgetin-Like 2 の発現低下はミクログリア機能を増加させる:微小管・形態・および活性の関係)
Austin N Smith 1, Alison Gregor 2, Lisa Baker 3, David J Sharp 4, Kimberly R Byrnes 5 6
Neuroscience Program, Uniformed Services University of the Health Sciences, Bethesda, MD, USA.
Abstract
The microtubule cytoskeleton regulates microglial morphology, motility, and effector functions. The microtubule-severing enzyme, fidgetin-like 2 (FL2), negatively regulates cell motility and nerve regeneration, making it a promising therapeutic target for central nervous system injury. Microglia perform important functions in response to inflammation and injury, but how FL2 affects microglia is unclear. In this study, we investigated the role of FL2 in microglial morphology and injury responses in vitro. We first determined that the pro-inflammatory stimulus, lipopolysaccharide (LPS), induced a dose- and time-dependent reduction in FL2 expression associated with reduced microglial ramification. We then administered nanoparticle-encapuslated FL2 siRNA to knockdown FL2 and assess microglial functions compared to negative control siRNA and vehicle controls. Time-lapse live-cell microscopy showed that FL2 knockdown increased the velocity of microglial motility. After incubation with fluorescently labeled IgG-opsonized beads, FL2 knockdown increased phagocytosis. Microglia were exposed to low-dose LPS after nanoparticle treatment to model injury-induced cytokine secretion. FL2 knockdown enhanced LPS-induced cytokine secretion of IL-1α, IL-1β, and TNFα. These results identify FL2 as a regulator of microglial morphology and suggest that FL2 can be targeted to increase or accelerate microglial injury responses.
微小管細胞骨格は、ミクログリアの形態、運動性、およびエフェクター機能を制御している。微小管切断酵素であるフィジェスチン様2(Fidgetin-Like 2; FL2)は、細胞運動性と神経再生を負に制御しており、中枢神経系損傷の有望な治療標的である。ミクログリアは炎症や損傷に対する重要な機能を果たすが、FL2がミクログリアにどのように影響するのかは不明である。本研究では、in vitroにおけるミクログリアの形態と損傷反応におけるFL2の役割を調査した。まず、炎症促進刺激であるリポ多糖(LPS)が用量依存的および時間依存的にFL2の発現を低下させ、ミクログリアの分岐が減少することを確認した。次に、FL2をノックダウンし、ネガティブコントロールのsiRNAおよびビヒクルコントロールと比較してミクログリアの機能を評価するために、FL2 siRNAをナノ粒子に封入して投与した。タイムラプスライブセル顕微鏡観察により、FL2のノックダウンによりミクログリアの運動速度が増加することが示された。蛍光標識IgG-オプソニン化ビーズとインキュベートした後、FL2ノックダウンにより貪食作用が増加した。損傷誘発性サイトカイン分泌のモデルとして、ナノ粒子処理後に低用量のLPSにミクログリアを暴露した。FL2ノックダウンにより、LPS誘発性サイトカイン分泌のIL-1α、IL-1β、およびTNFαが増加した。これらの結果から、FL2がミクログリアの形態の調節因子であり、FL2を標的とすることでミクログリアの損傷反応を増大または促進できる可能性が示唆された。
Fidgetin-like 2(FL2)
細胞骨格タンパク質であり、微小管の動態に関連する分子である。FL2は、微小管分解酵素として働き、微小管の解離を促進し、細胞の移動や分裂、形態形成に重要な役割を果たしている。この分子は、細胞内の微小管の安定性を調整することで、特定の細胞機能を調整する役割を担っている。先行研究によると、FL2の活性化は創傷治癒の促進や腫瘍細胞の動きの抑制に関与していることが示されている。特に、FL2の発現を抑制することで、細胞の移動速度が増加することが知られており、これは創傷治癒などの臨床応用において興味深い知見である。FL2は、Fidgetinファミリーの一部であり、他のFidgetin関連分子とともに、微小管の安定性や解離に関与し、細胞の動態や成長を制御する役割を持っている。したがって、FL2の機能は、細胞移動やがんの進展など、さまざまな生理的および病理的プロセスにおいて重要である。
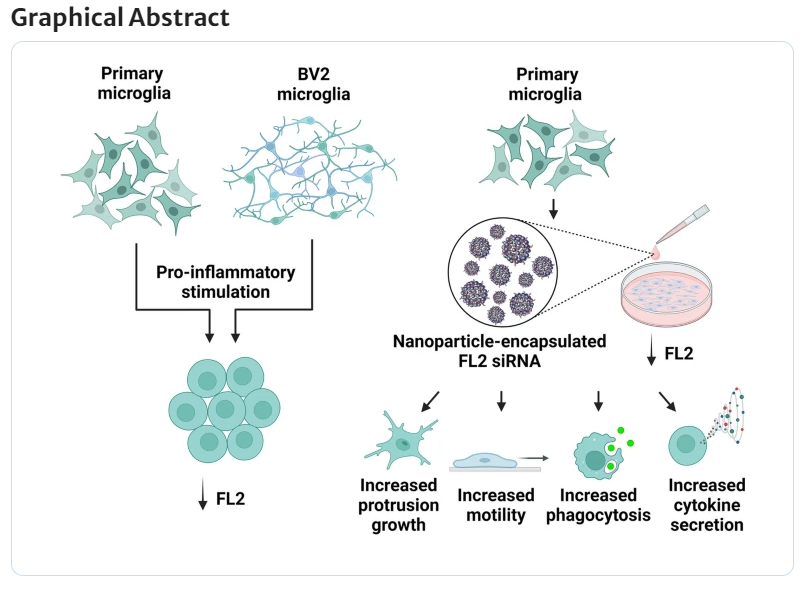
微小管細胞骨格はミクログリアの形態、運動性、エフェクター機能を制御する。微小管切断酵素Fidgetin-Like 2(FL2)は、細胞の運動性や神経再生を抑制し、中枢神経系(CNS)の損傷治療のターゲットとして注目されている。しかし、FL2がミクログリアにどのように影響を与えるかは不明である。本研究では、FL2がミクログリアの形態と損傷応答に及ぼす影響を調査した。LPS(リポポリサッカライド)刺激によりFL2の発現が低下し、ミクログリアのラミフィケーションが減少することを確認した。さらに、FL2をナノ粒子カプセル化したsiRNAを用いてノックダウンすると、ミクログリアの運動速度や食作用が増加し、炎症誘導性サイトカイン(IL-1α、IL-1β、TNFα)の分泌が増加した。これにより、FL2はミクログリアの形態を調節し、損傷応答を加速するターゲットとして注目されている。
Results
- FL2発現の低下
LPS処理により、FL2のmRNAレベルが顕著に低下することが確認された。特に、LPSを500ng/mLで処理した場合、ラットの一次ミクログリアにおいてFL2 mRNAのレベルは0.14倍に減少し(p < 0.0001)、BV2細胞では0.52倍に減少した(p = 0.001)。さらに、LPS刺激によるFL2の発現低下は時間および濃度依存的であった。10ng/mLおよび50ng/mLのLPS処理でもFL2の発現は6時間および24時間でそれぞれ低下し、細胞形態はラミファイド型からアメーバ型へと変化している。 - FL2ノックダウンによるミクログリアの機能変化
FL2のノックダウンにより、ミクログリアの運動速度が顕著に増加した。ナノ粒子カプセル化FL2 siRNA(SiFi2)を投与したグループのミクログリアは、PBSコントロールや非標的siRNA(SiCon)投与グループに比べ、平均速度が24.13 µm/hに増加した(p = 0.001、p = 0.009)。また、方向性の無い運動(ランダムな運動)であったが、FL2ノックダウンはミクログリアの移動距離(ユークリッド距離)を大幅に増加させた(p = 0.004)。 - 食作用の増加
FL2ノックダウンにより、ミクログリアの食作用が増加した。蛍光標識IgGオプソニンビーズを用いた実験では、FL2ノックダウンを行ったグループのミクログリアで食作用が約3倍に増加した(p = 0.004、p < 0.001)。なお、食作用を行ったミクログリアの割合には有意な変化は無かったが、取り込んだビーズの蛍光量が著しく増加していた。 - 炎症性サイトカインの分泌増加
LPS刺激後、FL2ノックダウンによってIL-1α、IL-1β、TNFαの分泌が増加した。特にIL-1αの分泌量は、LPS単独およびSiCon+LPSのグループと比較して、SiFi2+LPSのグループで顕著に増加した(p < 0.001)。IL-1βおよびTNFαも、SiFi2+LPSグループでLPS単独グループに比べて有意に分泌量が増加していた(p = 0.03、p = 0.005)。これにより、FL2ノックダウンがミクログリアの炎症反応を促進することが示唆された。
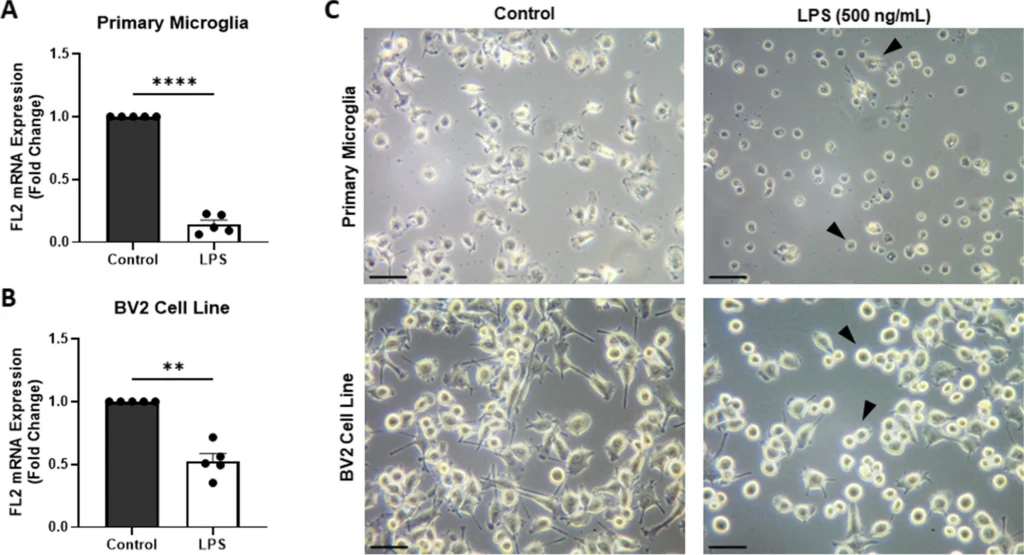
図1A: ラット初代培養ミクログリアおよびBV2細胞におけるFL2 mRNA発現レベルを示している。これらの細胞は、500ng/mLのLPSで24時間刺激されている。RT-qPCRにより、LPS処理後のFL2発現が有意に低下していることが示されている。一次ミクログリアでは、FL2 mRNAの発現が約0.14倍に減少し(p < 0.0001)、BV2細胞では約0.52倍に減少している(p = 0.001)。統計的検定には、Welchのt検定が使用されている。
図1B: LPSで処理された一次ミクログリアおよびBV2細胞の形態を示した位相差顕微鏡画像である。コントロール(DI水)のミクログリアは分岐したラミファイド形態を示しているが、LPS処理後は細胞突起が短くなり、より丸みを帯びたアメーバ型の形態を示している。画像中の矢印は、アメーバ型の活性化ミクログリアを示している。スケールバー:50μm
Discussion
FL2は、ミクログリアの形態と機能を制御する重要な因子であることが確認された。具体的には、LPS刺激によってFL2の発現が低下し、ミクログリアがアメーバ型形態へと変化し、運動性とサイトカイン分泌が促進された。この形態変化は、細胞骨格の再編成によるものであり、FL2の抑制が微小管の動態を活性化させることで実現されている。さらに、FL2のノックダウンは、ミクログリアの食作用やプロセス形成を促進し、監視機能や損傷応答を強化していることが明らかになった。
FL2の役割については、先行研究において、FL2が神経再生や細胞運動の抑制に関与することが示されていたが、今回の研究で初めて、FL2がミクログリアの形態と機能に直接的な影響を与えることが証明された。FL2ノックダウンにより、ミクログリアはより動的な微小管配列を持ち、細胞の移動やプロセス形成が促進され、炎症応答が強化された。この発見は、FL2が微小管動態の制御を介してミクログリアの機能を調節する重要な分子であることを示唆している。
一方で、FL2の発現低下によるミクログリアの機能変化が、CNS損傷の回復にどのような影響を与えるかについては、さらなる研究が必要である。例えば、炎症性サイトカインの過剰な分泌が損傷部位に悪影響を与える可能性があるため、FL2ノックダウンの長期的な効果や安全性についても検討が求められる。
また、今回の研究では、FL2ノックダウンによる微小管動態の変化がミクログリアのプロセス伸長や分枝形成を促進することが確認されたが、これが具体的にどのシグナル伝達経路を介して行われているかは明らかにされていない。今後の研究では、FL2の下流にある分子機構や、他の細胞内経路との相互作用についての解明が求められる。
最後に、FL2を標的とした治療法が神経再生やCNS損傷後の回復にどのように貢献できるかを解明することが重要である。FL2の抑制によってミクログリアの炎症応答や損傷応答を加速することで、CNSや末梢神経系の損傷治療に有効なアプローチとなる可能性が示唆されている。
