Scientific Reports volume 10, Article number: 21378 (2020) Published: 07 December 2020
Maternal immune activation induces sustained changes in fetal microglia motility (母体の免疫活性化は胎児のミクログリアの運動性に持続的な変化をもたらす)
Kana Ozaki 1 2, Daisuke Kato 1 3, Ako Ikegami 3, Akari Hashimoto 1 3, Shouta Sugio 3, Zhongtian Guo 1 3, Midori Shibushita 3, Tsuyako Tatematsu 3, Koichiro Haruwaka 1, Andrew J Moorhouse 4, Hideto Yamada 2, Hiroaki Wake 5 6 7
Department of Anatomy and Molecular Cell Biology, Nagoya University Graduate School of Medicine, Nagoya, Japan.
母体の免疫活性が胎児ミクログリアの動態に持続的な変化を引き起こすことを発見発達障害や統合失調症への関連を示唆
Abstract
Maternal infection or inflammation causes abnormalities in brain development associated with subsequent cognitive impairment and in an increased susceptibility to schizophrenia and autism spectrum disorders. Maternal immune activation (MIA) and increases in serum cytokine levels mediates this association via effects on the fetal brain, and microglia can respond to maternal immune status, but consensus on how microglia may respond is lacking and no-one has yet examined if microglial process motility is impaired. In this study we investigated how MIA induced at two different gestational ages affected microglial properties at different developmental stages. Immune activation in mid-pregnancy increased IL-6 expression in embryonic microglia, but failed to cause any marked changes in morphology either at E18 or postnatally. In contrast MIA, particularly when induced earlier (at E12), caused sustained alterations in the patterns of microglial process motility and behavioral deficits. Our research has identified an important microglial property that is altered by MIA and which may contribute to the underlying pathophysiological mechanisms linking maternal immune status to subsequent risks for cognitive disease.
母体の感染や炎症は、その後の認知障害や統合失調症や自閉症スペクトラム障害への罹患率上昇に関連する脳の発達異常を引き起こす。母体の免疫活性化(MIA)と血清サイトカインレベルの上昇は、胎児の脳への影響を介してこの関連を媒介し、ミクログリアは母体の免疫状態に反応することができるが、ミクログリアがどのように反応するかについてのコンセンサスは得られておらず、ミクログリア突起の運動性が損なわれるかどうかはまだ誰も調べていない。本研究では、2つの異なる妊娠月齢で誘発されたMIAが、異なる発達段階においてミクログリアの特性にどのような影響を及ぼすかを調べた。妊娠中期における免疫活性化は、胚ミクログリアにおけるIL-6発現を増加させたが、E18でも出生後でも形態に顕著な変化を起こすことはなかった。対照的に、MIAは、特に早期(E12)に誘導された場合、ミクログリアプロセスの運動パターンの持続的変化と行動障害を引き起こした。われわれの研究は、MIAによって変化する重要なミクログリア特性を同定し、それが母体の免疫状態とその後の認知疾患リスクとを結びつける根本的な病態生理学的メカニズムに寄与している可能性を示した。
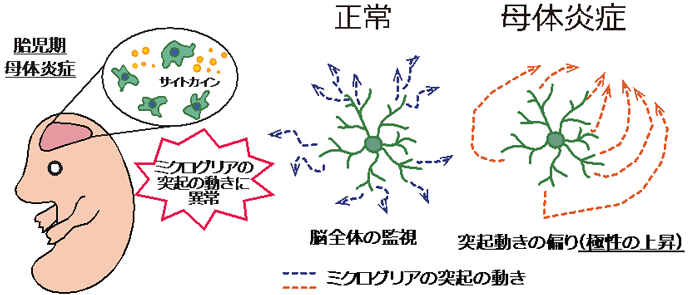
概要 (Abstract):
母体の感染や炎症は、胎児脳の発達異常を引き起こし、その結果、統合失調症や自閉症スペクトラム障害への感受性が高まる。母体免疫活性化(MIA)は胎児脳のミクログリアに影響を与え、その運動性に持続的な変化を引き起こす。本研究では、MIAが異なる胎齢で誘導された場合、胎児ミクログリアの特性にどのような影響を与えるかを調査した。MIAはIL-6の発現を増加させるが、ミクログリアの形態に明確な変化は見られず、運動パターンに持続的な変化が生じた。
背景 (Background):
母体の感染や炎症が胎児脳に与える影響は広く知られており、統合失調症や自閉症スペクトラム障害のリスクが高まる可能性がある。これらの影響は、母体免疫活性化(MIA)を通じて媒介され、特に胎児のミクログリアが影響を受ける。
方法 (Methods):
本研究では、妊娠12日目(E12)および15日目(E15)にポリIを注射し、胎児および出生後のミクログリアの生化学的および形態学的特性を評価した。さらに、2光子顕微鏡を用いて、胎児ミクログリアの運動性を定量化した。
結果 (Results):
MIAが妊娠12日目(E12)および15日目(E15)に母体に誘導された際、母体の肝臓や胎盤、胎児のミクログリアにおいてIL-6の発現が有意に増加したが、母体の脳ではこの変化は観察されなかった。胎児ミクログリアの形態学的解析では、E12およびE15のポリI注射後、胎児ミクログリアの細胞密度、ソマ面積、プロセスの総長、分岐数に大きな変化は見られなかったが、ミクログリアのプロセス運動性には顕著な変化が生じたことが確認された。
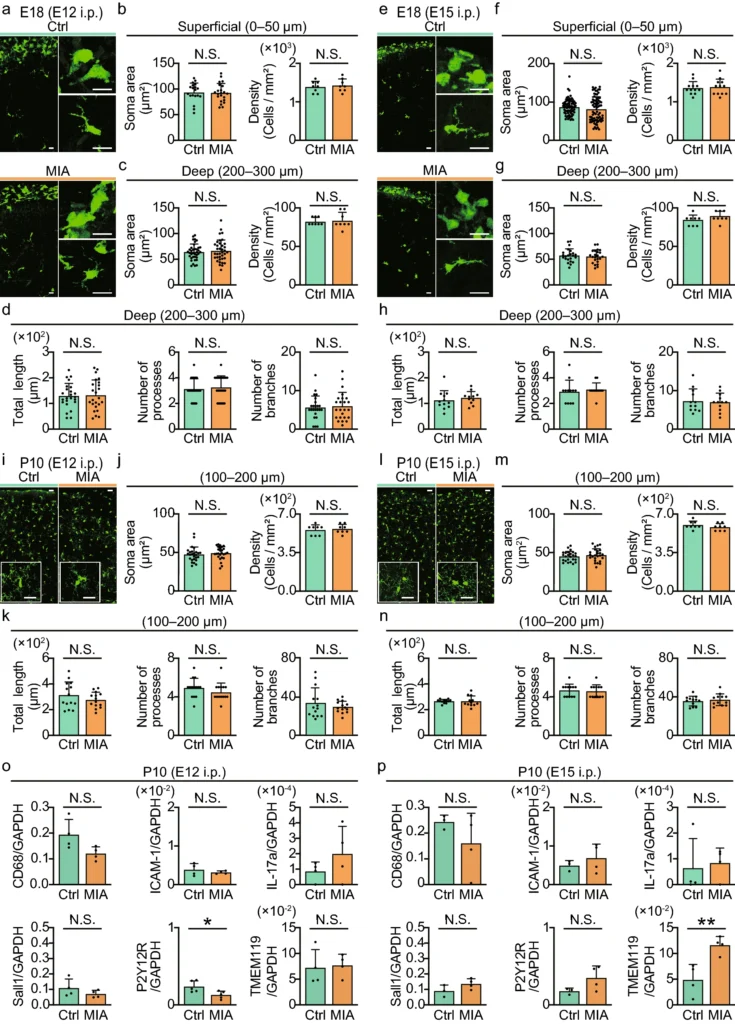
具体的には、E18の時点で胎児ミクログリアのプロセス先端速度が増加し、これはミクログリアが脳組織を監視する能力に関連していると考えられる。また、出生後10日目(P10)においては、E12でMIAを受けたミクログリアのプロセス先端速度が減少し、プロセスの動きの方向性が増加した。方向性の増加は、より反復的または標的化された運動パターンを示している。この傾向は、E12でMIAを受けたミクログリアで特に顕著であり、これはMIAによる影響がより持続的であることを示唆している。
P42(生後42日目)では、ミクログリアのプロセス運動性は基礎的には変化しなかったが、急性の炎症刺激(LPS注射)に対する応答として、E12でMIAを受けたミクログリアはプロセス先端速度と方向性の両方が増加した。このことは、MIAがミクログリアの長期的な機能に影響を及ぼし、特定の条件下での炎症応答を変化させる可能性を示している。
さらに、行動実験では、E12でMIAを受けた個体は、オープンフィールド試験で中央部に滞在する時間が減少し、移動距離も短縮した。また、社会的相互作用試験では、E12およびE15でMIAを受けた個体は、対マウスとの相互作用時間が減少し、特にE12でMIAを受けた個体ではその傾向が顕著であった。E12でMIAを受けた個体では、LPS注射後のミクログリアの運動性の変化と社会的行動の関連が示唆された。
結論 (Conclusion):
MIAは、胎児期および出生後のミクログリアのプロセス運動性に持続的な変化を引き起こし、この変化は神経発達障害、特に統合失調症や自閉症スペクトラム障害のリスク増加に寄与する可能性があると考えられる。E12でMIAを受けたミクログリアでは、プロセス運動性が増加し、特に出生後の神経回路の形成や修正に影響を与える可能性が示唆された。また、急性炎症に対する応答の違いが、社会的行動の変化と関連していることが観察されたことから、ミクログリアの運動性の変化が長期的に脳機能に影響を及ぼす可能性があると考えられる。この研究は、母体の免疫状態が胎児の脳発達に与える影響を解明し、ミクログリアの運動性をターゲットとした治療法の開発に新たな視点を提供するものである。
