Cell Reports Volume 38, Issue 13, 29 March 2022, 110600
Early stress-induced impaired microglial pruning of excitatory synapses on immature CRH-expressing neurons provokes aberrant adult stress responses (初期ストレスによって誘発された、未熟なCRH発現ニューロン上の興奮性シナプスのミクログリア刈り込み障害が、異常な成体ストレス応答を引き起こす)
Jessica L Bolton 1, Annabel K Short 2, Shivashankar Othy 3, Cassandra L Kooiker 2, Manlin Shao 2, Benjamin G Gunn 4, Jaclyn Beck 5, Xinglong Bai 2, Stephanie M Law 2, Julie C Savage 6, Jeremy J Lambert 7, Delia Belelli 7, Marie-Ève Tremblay 6, Michael D Cahalan 3, Tallie Z Baram 8
Department of Pediatrics, University of California, Irvine, Irvine, CA, USA; Department of Anatomy/Neurobiology, University of California, Irvine, Irvine, CA, USA.
Received 21 September 2021, Revised 10 February 2022, Accepted 8 March 2022, Available online 29 March 2022, Version of Record 29 March 2022
Highlights
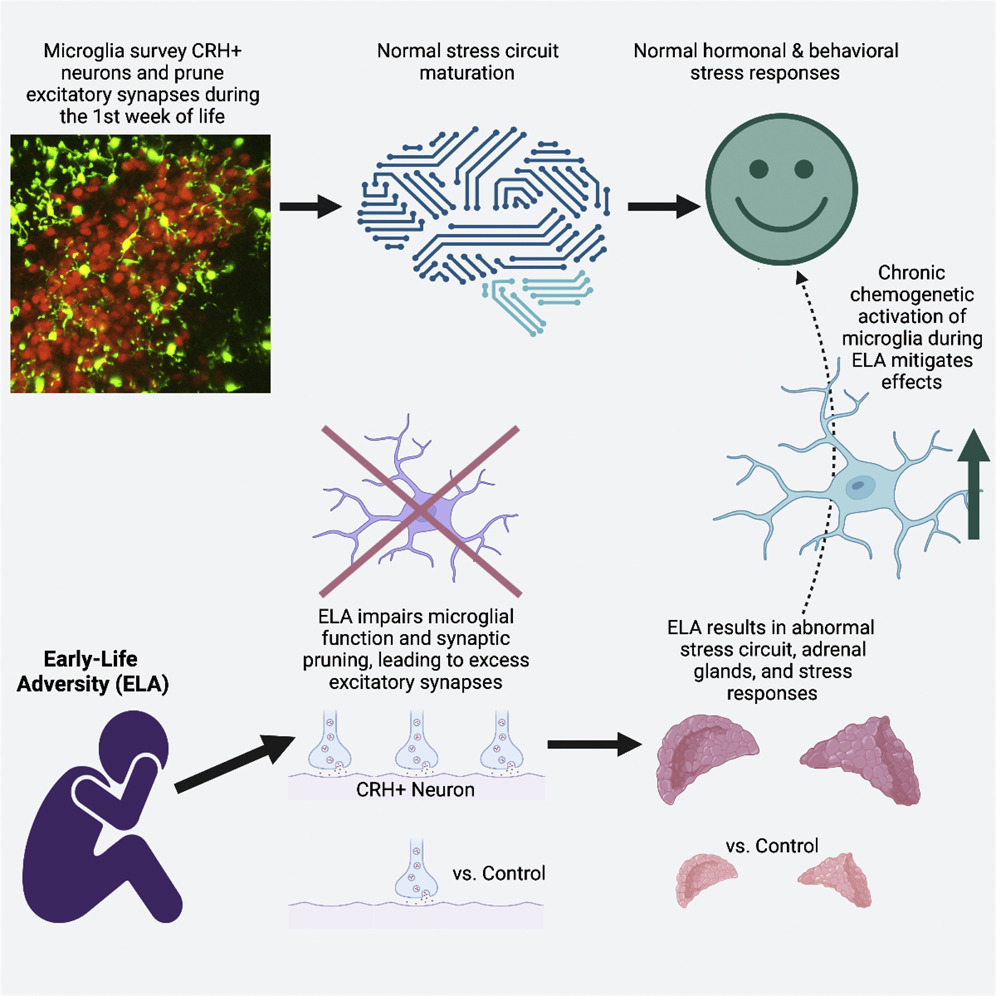
- Early-life stress (ELA) augments excitatory synapses on hypothalamic CRH cells 早期生活ストレス(ELA)は視床下部CRH細胞の興奮性シナプスを増大させる。
- During ELA, the adjacent microglia poorly survey and prune synapses on CRH neurons ELAの間、隣接するミクログリアはCRHニューロンのシナプスをうまく調査できず、刈り込んでしまう。
- •Mechanisms involve MerTK and yield aberrant hormonal and behavioral stress response そのメカニズムにはMerTKが関与しており、ホルモンと行動の異常なストレス反応をもたらす。
- •Chemogenetic microglial activation throughout ELA normalizes adult stress responses LA期間中の化学遺伝学的ミクログリア活性化により、成人のストレス応答が正常化する。
Keywords: microglia2-photon imagingprocess dynamicssynaptic pruningstresscorticotropin-releasing factorMerTKchemogenetics
Research topic: CP: Neuroscience
医学類3年のSさんが、初めて論文紹介してくださいました!
abb6bf866a0de6605d85fab170fbdeb7Abstract
Several mental illnesses, characterized by aberrant stress reactivity, often arise after early-life adversity (ELA). However, it is unclear how ELA affects stress-related brain circuit maturation, provoking these enduring vulnerabilities. We find that ELA increases functional excitatory synapses onto stress-sensitive hypothalamic corticotropin-releasing hormone (CRH)-expressing neurons, resulting from disrupted developmental synapse pruning by adjacent microglia. Microglial process dynamics and synaptic element engulfment were attenuated in ELA mice, associated with deficient signaling of the microglial phagocytic receptor MerTK. Accordingly, selective chronic chemogenetic activation of ELA microglia increased microglial process dynamics and reduced excitatory synapse density to control levels. Notably, selective early-life activation of ELA microglia normalized adult acute and chronic stress responses, including stress-induced hormone secretion and behavioral threat responses, as well as chronic adrenal hypertrophy of ELA mice. Thus, microglial actions during development are powerful contributors to mechanisms by which ELA sculpts the connectivity of stress-regulating neurons, promoting vulnerability to stress and stress-related mental illnesses.
異常なストレス反応性を特徴とするいくつかの精神疾患は、しばしば小児期逆境体験 (早期逆境; ELA)後に発症する。しかし、ELAがストレスに関連した脳回路の成熟にどのように影響し、このような永続的な脆弱性を引き起こすのかは不明である。我々は、ELAがストレスに敏感な視床下部のコルチコトロピン放出ホルモン(CRH)発現ニューロンへの機能的興奮性シナプスを増加させ、その結果、近傍のミクログリアによるシナプス刈り込みが阻害されることを発見した。ELAマウスでは、ミクログリアの食細胞受容体であるMerTKのシグナル伝達が欠損しているため、ミクログリア突起の動態とシナプス構成要素の貪食が減弱していた。したがって、ELAミクログリアの選択的な慢性化学遺伝学的活性化は、ミクログリア突起のダイナミクスを増加させ、興奮性シナプス密度をコントロールレベルまで減少させた。注目すべきことに、ELAミクログリアの選択的な初期活性化は、ELAマウスの慢性副腎肥大だけでなく、ストレス誘発ホルモン分泌や行動的脅威反応など、成体の急性および慢性ストレス応答を正常化した。このように、発生過程におけるミクログリアの作用は、ELAがストレス制御ニューロンの結合性を剪定し、ストレスやストレス関連精神疾患に対する脆弱性を促進するメカニズムに強力に寄与している。
Introduction
幼少期の逆境(ELA)は、ストレス反応に関連する脳回路の成熟を妨げ、長期的なストレスに対する異常な反応を引き起こすことが多い。研究は、ELAがミクログリアによるシナプス刈り込みを阻害し、興奮性シナプスの数を増加させ、結果として成人期のホルモンおよび行動におけるストレス反応の異常を引き起こすことを示した。
脳の発達は遺伝と早期経験の影響を受ける。特に、幼少期のストレスや貧困は脳の構造的および機能的な成熟に影響を与え、認知的および感情的な脆弱性を増加させることが知られている。ELAは、うつ病のような神経精神疾患のリスク要因であり、異常なストレス反応を引き起こす。
方法
ELAモデルを使用して、ミクログリアのプロセスダイナミクスとシナプスの刈り込みに対する影響を評価。光二重子イメージングや化学遺伝学的活性化などを用いて、ELAによるミクログリアの機能障害を測定した。
Results
ELAは興奮性シナプスの数を増加させる:
幼少期の逆境(ELA)を経験したマウスでは、視床下部の副交感神経核(PVN)にあるコルチコトロピン放出ホルモン(CRH)を発現するニューロンにおいて、興奮性シナプスの数が増加した。具体的には、vGlut2(興奮性シナプスのプレシナプス要素)とPSD95(ポストシナプス密度)の共局在が増加し、シナプス密度が高まった。これらのシナプス増加は、生後10日目(P10)および24~25日目(P24-25)に確認され、持続的なものであることが示された。
ミクログリアのプロセスダイナミクスが低下:
ELAマウスでは、ミクログリアのプロセス(突起)の動態が著しく低下していることが観察された。具体的には、ミクログリアのプロセスが神経細胞に接触する頻度や移動速度が低下しており、これがシナプスの刈り込み機能に影響を与えていると考えられる。
シナプスのエンゴルフメント(取り込み)が減少:
ミクログリアによるシナプス要素の取り込みがELAマウスで減少していることが確認された。これは、特にCRHを発現するニューロンに隣接するミクログリアで顕著に見られ、これにより興奮性シナプスの過剰形成が引き起こされていると考えられる。
MerTK受容体の役割:
ELAマウスでは、ミクログリアにおけるMerTK受容体の発現が低下しており、これがシナプスのエンゴルフメントの減少に寄与していることが明らかになった。MerTK受容体の阻害によって、コントロールマウスではシナプスの数が増加したが、ELAマウスでは変化が見られなかった。
化学遺伝学的活性化による効果:
ミクログリアを化学遺伝学的に活性化することで、ELAマウスにおいて興奮性シナプスの数がコントロールレベルに戻り、成人期のストレス反応が正常化した。具体的には、ELAによる異常なストレスホルモンの分泌や行動反応が緩和され、正常なストレス応答が回復した。
Discussion
ミクログリアの役割の重要性:
本研究は、ミクログリアがストレス反応を調節するニューロンのシナプス刈り込みにおいて重要な役割を果たしていることを示している。ELAによるミクログリアの機能障害が、PVN-CRHニューロンにおけるシナプスの過剰形成を引き起こし、これが成人期の異常なストレス反応につながるというメカニズムが提案されている。
プロセスダイナミクスとシナプス刈り込み:
ミクログリアのプロセスダイナミクス(突起の動き)は、シナプス刈り込み機能を反映する重要な指標であると考えられる。ELAは、このプロセスダイナミクスを阻害し、その結果、シナプスの刈り込みが減少することが確認された。この関係は、将来的にさらなる研究が必要である。
MerTK受容体とシナプス刈り込みの関係:
MerTK受容体がシナプス刈り込みに果たす役割は重要であり、ELAによってその機能が抑制されることが示唆されている。MerTK受容体の発現と活性が低下することで、シナプスの過剰形成が引き起こされ、それが異常なストレス反応に寄与している可能性がある。
化学遺伝学的活性化の治療的可能性:
ミクログリアの化学遺伝学的活性化は、ELAによるストレス反応の異常を改善する可能性が示されている。このアプローチは、将来的な治療戦略として、ストレス関連障害の予防や治療に応用できる可能性がある。
神経とミクログリアの相互作用:
ELAはミクログリアだけでなく、CRHを発現するニューロン自体にも影響を与える可能性がある。この研究では、ELAが神経とミクログリア間のクロストーク(相互作用)をどのように変化させるかが示唆されているが、今後の研究でその詳細なメカニズムの解明が求められる。
性差の影響:
本研究では、ELAが雄のマウスにおいて顕著に影響を与えた一方で、雌のマウスではシナプス数の増加が見られなかったことが示されている。この性差は、ストレス反応や脳回路の成熟における性別の違いを反映している可能性があり、雌のマウスを対象としたさらなる研究が必要である。
従来の研究との新規性
ミクログリアが特定のストレス関連ニューロンにおいて選択的にシナプスを刈り込む役割を持つこと、そしてELAがこのプロセスを妨げることを示した点で新規性がある。研究は主にスライス培養を使用して行われたため、in vivoの文脈でのミクログリアの機能を完全に反映しているわけではない。また、MerTK阻害剤のオフターゲット効果についてもさらなる研究が必要である。発達中のミクログリア機能を調節することで、ストレス関連障害の予防や治療に新たなターゲットを提供する可能性がある。
