本日は、研究室演習で参加した医学群医学類3年生が自己紹介を行いました。様々な分野でご活躍のようなので、今後の研究の進展が楽しみです。続けて、同じく医学群医学類3年生が論文紹介しました。
Cell Rep. 2024 May 30;43(6):114216. doi: 10.1016/j.celrep.2024.114216.
Microglia-astrocyte crosstalk in the amyloid plaque niche of an Alzheimer’s disease mouse model, as revealed by spatial transcriptomics (空間トランスクリプトミクスによって明らかにされたアルツハイマー病マウスモデルのアミロイドプラークニッチにおけるミクログリアとアストロサイトの相互作用)
Summary
The amyloid plaque niche is a pivotal hallmark of Alzheimer’s disease (AD). Here, we employ two high-resolution spatial transcriptomics (ST) platforms, CosMx and Spatial Enhanced Resolution Omics-sequencing (Stereo-seq), to characterize the transcriptomic alterations, cellular compositions, and signaling perturbations in the amyloid plaque niche in an AD mouse model. We discover heterogeneity in the cellular composition of plaque niches, marked by an increase in microglial accumulation. We profile the transcriptomic alterations of glial cells in the vicinity of plaques and conclude that the microglial response to plaques is consistent across different brain regions, while the astrocytic response is more heterogeneous. Meanwhile, as the microglial density of plaque niches increases, astrocytes acquire a more neurotoxic phenotype and play a key role in inducing GABAergic signaling and decreasing glutamatergic signaling in hippocampal neurons. We thus show that the accumulation of microglia around hippocampal plaques disrupts astrocytic signaling, in turn inducing an imbalance in neuronal synaptic signaling.
アミロイド斑ニッチはアルツハイマー病(AD)の極めて重要な特徴である。ここでは、2つの高分解能空間トランスクリプトーム(ST)プラットフォーム、CosMxとSpatial Enhanced Resolution Omics-sequencing(Stereo-seq)を用いて、ADマウスモデルのアミロイドプラークニッチにおけるトランスクリプトームの変化、細胞組成、シグナル伝達の擾乱を明らかにする。その結果、プラークニッチの細胞組成に不均一性が認められ、ミクログリア集積の増加が顕著であった。プラーク近傍のグリア細胞のトランスクリプトーム変化をプロファイリングし、プラークに対するミクログリアの反応は異なる脳領域で一貫しているが、アストロサイトの反応はより不均一であると結論した。一方、プラークニッチのミクログリア密度が増加するにつれて、アストロサイトはより神経毒性表現型を獲得し、海馬ニューロンのGABA作動性シグナル伝達を誘導し、グルタミン酸作動性シグナル伝達を減少させる上で重要な役割を果たす。このように、海馬プラーク周辺にミクログリアが蓄積すると、アストロサイトのシグナル伝達が阻害され、ひいては神経細胞のシナプスシグナル伝達の不均衡が引き起こされることが示された。
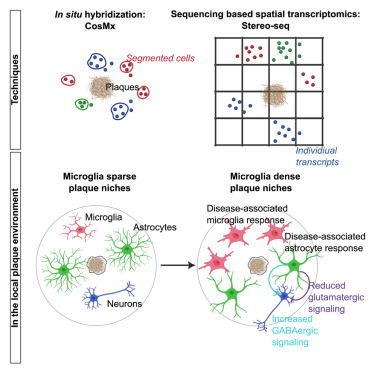
Highlights
- プラークに対するミクログリアの反応は、異なる脳領域で一貫している。
- アミロイド斑の局所近傍は不均一な組成を示す。
- ミクログリアが密集するプラークのニッチに存在するアストロサイトは、より神経毒性を示す。
- 活性化したアストロサイトは神経細胞のシグナル伝達を阻害するようである。
Keywords: Alzheimer’s disease, cellular phase, spatial transcriptomic, micorglia, astrocytes, amyloid plaque, intercellular communication, plaque-induced changes
https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00544-8
Results
Results
結果
この研究では、アルツハイマー病(AD)モデルマウスにおけるアミロイドプラークニッチでのミクログリアとアストロサイトのクロストークを調査した。
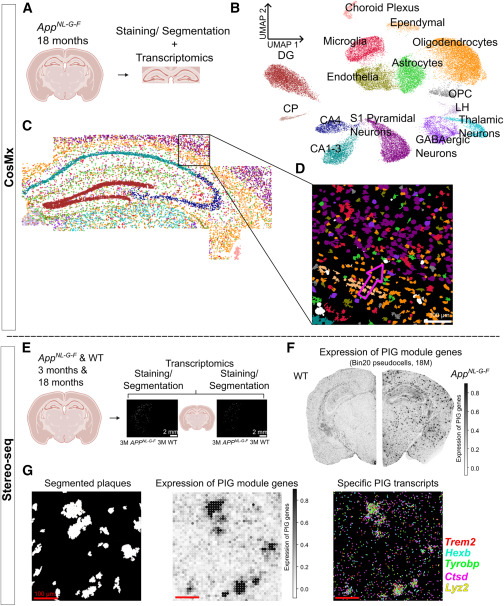
図1: 実験設定とセグメンテーション
Figure 1a: CosMxプラットフォームを使用して得られた、18ヶ月齢のAppNL-G-Fマウスの海馬および隣接領域の前額断のデータを示す。
Figure 1b: CosMxデータセットにおける37,840の高品質な細胞の主要な細胞タイプを示すUMAPプロット。
Figure 1c: 特定の組織セクションにおけるグルタミン酸作動性ニューロンの空間的分布を示す。
Figure 1d: セグメンテーションされたプラークと細胞のズームイン画像。
Figure 1e: Stereo-seq実験の実験設定を示す模式図。
図2: プラーク近傍の細胞反応
Figure 2a: CosMxデータセットで解決されたプラークに近接する細胞の相対的な細胞タイプの構成を示すヒストグラム。
Figure 2b: プラーク近傍のミクログリアの遺伝子発現の変化を示すMAプロット。左図: Cx3cr1やTmem119などのホームスタティックマーカーがダウンレギュレーションし、ApoeやTrem2などのDAMマーカーがアップレギュレーションしていることを示す。右図: 脳の異なる領域(海馬と皮質)でのミクログリアの遺伝子発現プロファイルを比較している。
Figure 2c: プラークに接近するアストロサイトの遺伝子発現の変化を示すMAプロット。左図: GfapなどのDAAマーカーがアップレギュレーションしていることを示す。右図: 脳の異なる領域(海馬と皮質)でのアストロサイトの遺伝子発現プロファイルを比較している。
Figure 2d: マイクログリアとアストロサイト間の受容体-リガンド(RL)ペアの共起強度の変化を示すプロット。Csf1-Csf1rおよびCd44-Tyrobpの相互作用が強化されていることを示す。
図3: アミロイドプラークニッチの細胞組成の不均一性
Figure 3a: 平均的なプラークニッチの細胞組成を示す代表的な図。
Figure 3b: プラークニッチの細胞タイプ組成の不均一性を示すUMAPプロット。
Figure 3c: プラークニッチのミクログリア密度とDAMスコアの間の相関を示すプロット。
Figure 3d: プラークニッチにおけるミクログリア密度に応じたアストロサイトの遺伝子発現の変化を示すMAプロット。
Figure 3e: アストロサイトのDAAマーカーの遺伝子セットエンリッチメント解析(GSEA)を示すプロット。
Figure 3f: Stereo-seqプラークニッチのUMAPプロット。
Figure 3g: Stereo-seqプラークニッチの予測されたミクログリア密度を示すプロット。
Figure 3h: 3ヶ月齢と18ヶ月齢のマウスのプラークニッチのミクログリア密度を比較しているボックスプロット。
Figure 3i & 3j: Stereo-seqデータセットにおけるプラークニッチのミクログリア密度とDAMおよびDAAマーカーの発現レベルの相関を示すプロット。
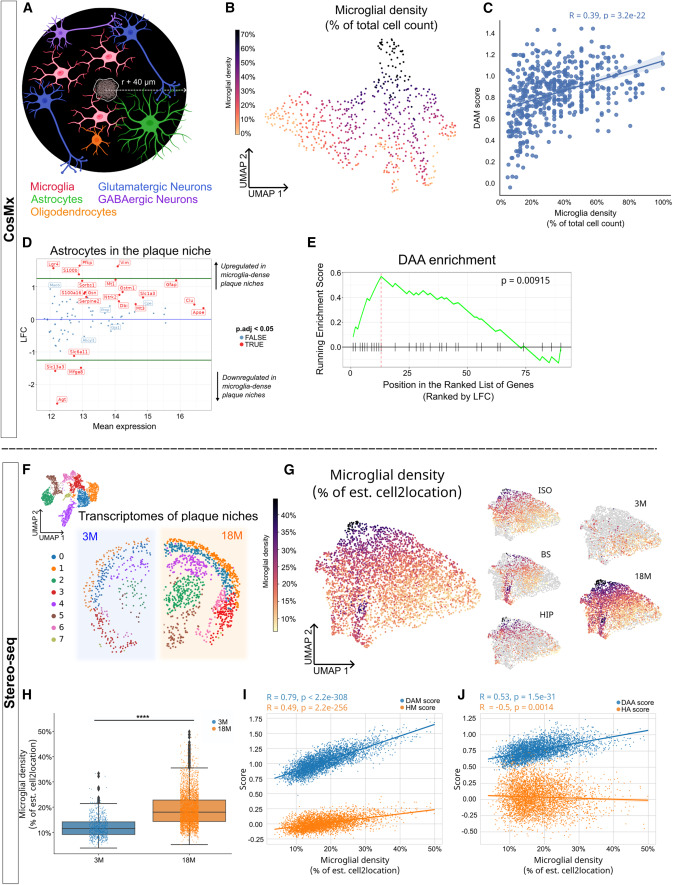
図4: プラークニッチ内の細胞間相互作用
Figure 4a: CosMxプラットフォームで予測された、316の海馬プラークニッチにおける異なる細胞間のRLペアの数を示す。アストロサイトは他の細胞タイプと多くのRL相互作用ペアを持つことを示している。
Figure 4b: 海馬のアストロサイトとニューロン間のRLペアの強度が、プラークニッチのミクログリア密度とどのように相関しているかを示す。
Figure 4c: プラークニッチのCA1–CA3ニューロンにおけるミクログリア密度に対する遺伝子発現の変化を示すMAプロット。GABAシグナル伝達に関連する遺伝子Gabrb1が黄色でハイライトされている。
Figure 4d: 18ヶ月齢の海馬Stereo-seqプラークニッチにおけるミクログリア密度に対する遺伝子発現の変化を示すMAプロット。
まとめ
ミクログリアはプラークに近づくにつれて遺伝子発現が変化し、プラークの近傍で神経毒性の高い表現型を獲得することが確認された。アストロサイトも同様にプラークに近づくにつれて遺伝子発現が変化し、特にGABA作動性シグナル伝達の誘導とグルタミン酸作動性シグナル伝達の減少が見られた。具体的には、CA1–CA3ニューロンではGABA受容体サブユニットGabrb1の発現が増加し、同時にナトリウムチャネルNav3の発現も上昇した。これに対し、神経の長期増強(LTP)に関連するNos1の発現は減少した。
プラークの近くにおいては、アストロサイトからのCluやApoeなどのシグナルがミクログリアのTrem2経路に影響を与えることが示された。さらに、プラークニッチのミクログリア密度が増加するにつれて、これらのグリア細胞はより病気関連の表現型を獲得する傾向があった。この傾向は、特に18ヶ月齢のマウスで顕著だった。
Conclusion
本研究では、2つの新しいST法を用いて、局所的なアミロイドプラーク環境における細胞およびトランスクリプトームの変化を特徴付けた。プラークニッチにおけるこれまでに定義された細胞タイプのシグネチャーを発展させ、これらの微小環境におけるミクログリアとアストロサイトのクロストークのさらなる証拠を提供した。特筆すべきは、グリア細胞の種類を超えて解析を拡張し、ミクログリアとアストロサイトの変化が、局所アミロイドプラーク環境における神経細胞のシナプスシグナル伝達に及ぼす破壊的影響を特徴付けたことである。プラーク病態が成熟するにつれて、海馬ニューロンとのアストロサイトの相互作用が、抑制性GABAシグナル伝達の増加と興奮性グルタミン酸作動性シグナル伝達の減少を通して、神経細胞シグナル伝達を破壊することが示唆された。こうして、プラーク病態の進行と下流のニューロンへの有害な影響とを結びつけるシグナル伝達パートナーの候補を提示する。これと並行して、高解像度のSTデータセットをプローブするための計算アプローチと分析手法の枠組みを提示する。
66a65cc285be8912e715b42c31e5e4c0