Nature. 2024 May 1. doi: 10.1038/s41586-024-07469-y.
A body-brain circuit that regulates body inflammatory responses (身体の炎症反応を調節する体脳回路)
Hao Jin # 1 2 3, Mengtong Li # 4 5, Eric Jeong 4 5, Felipe Castro-Martinez 6, Charles S Zuker 7 8
Zuckerman Mind Brain Behavior Institute, Howard Hughes Medical Institute and Department of Biochemistry and Molecular Biophysics, Columbia University, New York, NY, USA. hao.jin@NIH.gov.
Abstract
身体-脳軸は、生物生理学の主要な伝導体として台頭してきている。それは、臓器機能1,2、代謝3、栄養状態4-6を感知し、制御している。ここでわれわれは、末梢からの免疫侵害が体脳軸を強力に活性化し、免疫応答を制御することを示す。我々は、炎症性サイトカインと抗炎症性サイトカインが迷走神経細胞の異なる集団と交信し、炎症反応の発生を脳に知らせることを明らかにした。その結果、脳は末梢の免疫反応の経過を厳密に調節するようになった。この身体から脳への回路を遺伝的にサイレンシングすると、制御不能な炎症反応が生じた。対照的に、この回路をサイレンシングするのではなく活性化することで、免疫応答の卓越した神経制御が可能になる。われわれは、単細胞RNA配列決定と機能イメージングを組み合わせて、この神経-免疫軸の回路構成要素を同定し、その選択的操作によって、抗炎症状態を高めながら炎症反応を効果的に抑制できることを示した。免疫反応の経過を脳が誘発的に変化させることで、自己免疫疾患からサイトカインストームやショックに至るまで、幅広い免疫疾患の調節に新たな可能性がもたらされる。
背景:免疫反応の適切なバランスは、生体の健康と生存にとって極めて重要である。過剰なプロ炎症状態は、自己免疫疾患や炎症性疾患を引き起こす。免疫反応を調整するメカニズムの理解は、免疫系の機能についての重要な洞察を提供し、免疫異常を特徴とする疾患の治療に新しい戦略を提供する可能性がある。
方法:この研究では、LPS(リポ多糖)を使用してマウスモデルにおける自然免疫反応を誘発し、末梢血サンプル中のサイトカイン変化を測定した。次に、最初期遺伝子Fosの発現を用いて、脳の活性化をプロキシとして神経活動を評価した。また、単一細胞RNAシークエンシング(scRNA-seq)と機能的イメージングを組み合わせて、この神経-免疫軸の回路要素を特定した。化学遺伝学的方法を用いて、特定の神経集団を活性化または抑制し、その影響を評価した。
Results
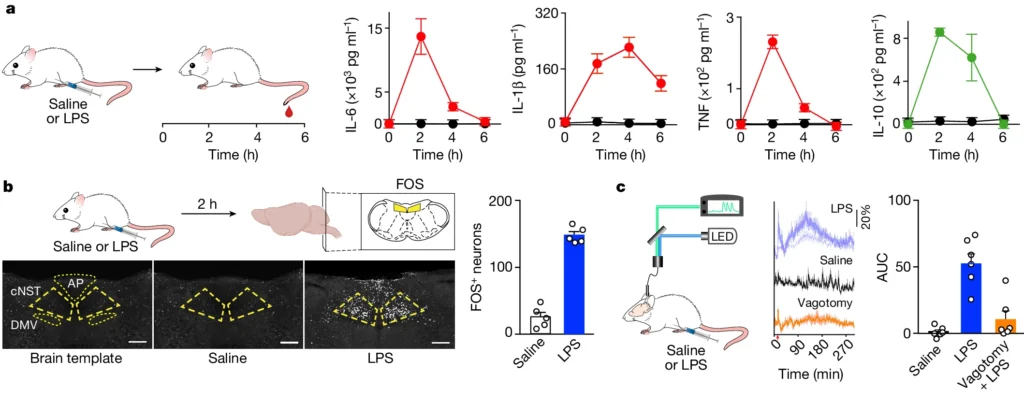
1. LPS注射による免疫応答の誘発 LPS(リポ多糖)の腹腔内注射により、マウスの末梢血中のプロ炎症性サイトカイン(IL-6、IL-1β、TNF-α)および抗炎症性サイトカイン(IL-10)のレベルが大幅に増加し、ピークは注射後約2時間で観察された(図1a)。この結果は、LPSが強力な免疫刺激物質として作用することを示している。
2. Fos発現による脳の活性化 LPS注射後、即時早期遺伝子Fosの発現を調査したところ、孤束核 (caudal Nucleus of the Solitary Tract cNST)およびArea Postrema(最後野 AP)のニューロンで強いFosラベルが確認された。特に、cNSTのラベルはLPS注射に応答して著明であり、cNSTが迷走神経を介して免疫応答を感知する主要な中枢であることが示唆された(図1b)。
3. cNSTニューロンの遺伝的サイレンシング LPSに応答して活性化されたcNST(後側孤束核)ニューロンを遺伝的にサイレンシングすると、プロ炎症性サイトカインのレベルが著しく増加し、抗炎症性サイトカインのレベルが減少した。具体的には、IL-1βのレベルは200 pg/mlから800 pg/mlに増加し、IL-10のレベルは750 pg/mlから約250 pg/mlに減少した(図2b)。この結果は、cNSTニューロンが炎症反応の調節において重要な役割を果たしていることを示している。
4. cNSTニューロンの化学遺伝学的活性化 逆に、cNSTニューロンを化学遺伝学的に活性化すると、プロ炎症性サイトカインのレベルが大幅に減少し、抗炎症性サイトカインのレベルが大幅に増加した。具体的には、プロ炎症性サイトカインのレベルは70%減少し、抗炎症性サイトカインのレベルは約10倍に増加した(図2c)。
5. TRPA1およびCALCA陽性迷走神経細胞の役割 迷走神経のTRPA1陽性細胞は抗炎症性サイトカインに、CALCA陽性細胞はプロ炎症性サイトカインに応答することが確認された(図4a)。TRPA1陽性細胞を活性化すると、IL-10のレベルが大幅に増加し、プロ炎症性サイトカインのレベルが大幅に減少した(図5b)。一方、CALCA陽性細胞を活性化すると、プロ炎症性サイトカインのレベルが減少した(図5e)。
6. サルモネラ感染モデルおよび潰瘍性大腸炎モデル DBH陽性cNSTニューロンやTRPA1陽性迷走神経細胞を活性化することで、致死的なLPS注射後のマウスの生存率が大幅に向上した(図6b)。また、潰瘍性大腸炎モデルにおいても、TRPA1陽性迷走神経細胞の活性化により、大腸の損傷が防止され、プロ炎症性サイトカインのレベルが減少した(図6d-f)。
Results
1. cNSTニューロンの中心的役割 この研究は、cNSTニューロンが末梢免疫反応の調節において中心的な役割を果たしていることを示しました。特に、これらのニューロンがプロおよび抗炎症性シグナルを識別し、脳がこれらのシグナルに基づいて適切な免疫応答を制御することが明らかになりました。
2. 神経-免疫軸の新たな理解 迷走神経がプロ炎症性および抗炎症性サイトカインの異なる集団と通信し、脳に炎症反応を通知するメカニズムを詳細に解明しました。これにより、免疫調節の新しい視点が提供され、脳がどのようにして免疫応答を調節するかについての理解が深まりました。
3. 治療的応用の可能性 この研究は、自己免疫疾患やサイトカインストームなどの治療に新しい戦略を提供する可能性を示しています。特に、cNSTニューロンやTRPA1陽性迷走神経細胞の標的化により、炎症反応を効果的に制御し、免疫バランスを回復させることができると考えられます。
4. さらなる研究の必要性 本研究はマウスモデルで行われたため、人間への適用可能性を検討するためにはさらなる研究が必要です。また、他の神経集団や条件での効果も確認する必要があります。
5. 結論 cNSTニューロンは末梢免疫反応の調節において重要な役割を果たし、これらのニューロンの活性化または抑制により、炎症反応を効果的に調整できることが示されました。この神経-免疫軸の理解は、免疫疾患の治療に新しい道を開く可能性があります。
先行研究との差異:この研究は、脳と免疫系の相互作用を解明し、迷走神経がどのようにして脳に炎症シグナルを伝達するかを詳細に説明するものである。特に、cNST神経がプロおよび抗炎症反応を調節する役割を持つことを示し、免疫調節の新しい視点を提供する。
本研究の限界:本研究はマウスモデルで行われており、人間での適用可能性には更なる研究が必要である。化学遺伝学的手法の効果は、他のモデルや条件でも確認する必要がある。
応用の可能性:この研究は、自己免疫疾患やサイトカインストームの治療、免疫バランスの調整に新しい治療戦略を提供する。特に、DBH陽性神経の標的化やTRPA1陽性迷走神経の活性化により、炎症反応を効果的に抑制し、抗炎症状態を強化することができる。
