Front Neurosci. 2022 Mar 14:16:828646. doi: 10.3389/fnins.2022.828646. eCollection 2022.
Interleukin-17a Induces Neuronal Differentiation of Induced-Pluripotent Stem Cell-Derived Neural Progenitors From Autistic and Control Subjects (インターロイキン-17aは自閉スペクトラム症および対照被験者の人工多能性幹細胞由来神経前駆細胞の神経分化を誘導する)
Ana Karolyne Santos Gomes 1, Rafaelly Mayara Dantas 1, Bruno Yukio Yokota 1, André Luiz Teles E Silva 1, Karina Griesi-Oliveira 1, Maria Rita Passos-Bueno 2, Andréa Laurato Sertié 1
1. Hospital Israelita Albert Einstein, Centro de Pesquisa Experimental, São Paulo, Brazil.
2. Centro de Estudos do Genoma Humano e Células Tronco, Instituto de Biociências, Universidade de São Paulo, São Paulo, Brazil.
サンパウロ大学(ポルトガル語:Universidade de São Paulo、略称 USP)は、ブラジル・サンパウロ州にある州立大学である。ラテンアメリカでは、事実上一番難関な大学、またブラジルで最も入学が難しい大学であり、世界大学ランキングのベスト100にも入っている。ブラジルやヨーロッパ諸国から著名な教授などが集っている。学生数8万人のうち、日系人が14%を占める。授業料は基本的に無料であるので、入学試験の競争率は非常に高い。また、卒業するのも非常に厳しい大学である。過去の多くのブラジル連邦共和国大統領は、この大学からの出身者が多い。(Wkipedia)
社会行動とIL-17 (12月18日 Natureオンライン掲載論文)
歯の神経を構成する歯髄細胞には、神経を再生する力がある。歯髄細胞からiPS細胞が効率的に作れるということがわかっている。本研究では、ASD患者の歯髄細胞からiPSCを誘導し、組換えIL17Aタンパクをかける、などのアッセイを行っている。
Abstract
Prenatal exposure to maternal immune activation (MIA) has been suggested to increase the probability of autism spectrum disorder (ASD). Recent evidence from animal studies indicates a key role for interleukin-17a (IL-17a) in promoting MIA-induced behavioral and brain abnormalities reminiscent of ASD. However, it is still unclear how IL-17a acts on the human developing brain and the cell types directly affected by IL-17a signaling. In this study, we used iPSC-derived neural progenitor cells (NPCs) from individuals with ASD of known and unknown genetic cause as well as from neurotypical controls to examine the effects of exogenous IL-17a on NPC proliferation, migration and neuronal differentiation, and whether IL-17a and genetic risk factors for ASD interact exacerbating alterations in NPC function. We observed that ASD and control NPCs endogenously express IL-17a receptor (IL17RA), and that IL-17a/IL17RA activation modulates downstream ERK1/2 and mTORC1 signaling pathways. Exogenous IL-17a did not induce abnormal proliferation and migration of ASD and control NPCs but, on the other hand, it significantly increased the expression of synaptic (Synaptophysin-1, Synapsin-1) and neuronal polarity (MAP2) proteins in these cells. Also, as we observed that ASD and control NPCs exhibited similar responses to exogenous IL-17a, it is possible that a more inflammatory environment containing other immune molecules besides IL-17a may be needed to trigger gene-environment interactions during neurodevelopment. In conclusion, our results suggest that exogenous IL-17a positively regulates the neuronal differentiation of human NPCs, which may disturb normal neuronal and synaptic development and contribute to MIA-related changes in brain function and behavior.
母体免疫活性化(MIA)への出生前曝露は、自閉スペクトラム症(ASD)の可能性を高めることが示唆されている。動物実験から得られた最近の証拠は、MIAによって誘発されたASDを思わせる行動や脳の異常を促進する上で、インターロイキン-17a(IL-17a)が重要な役割を果たしていることを示している。しかし、IL-17aがヒトの発達中の脳にどのように作用するのか、またIL-17aシグナル伝達によって直接影響を受ける細胞タイプはまだ不明である。本研究では、遺伝的原因が判明しているASD患者と不明なASD患者、および定型発達者から採取したiPSC由来の神経前駆細胞(NPC)を用いて、外因性IL-17aがNPCの増殖、遊走、神経分化に及ぼす影響、およびIL-17aとASDの遺伝的危険因子が相互作用してNPCの機能変化を悪化させるかどうかを調べた。ASDおよび対照群のNPCはIL-17a受容体(IL17RA)を内因性に発現しており、IL-17a/IL17RAの活性化が下流のERK1/2およびmTORC1シグナル伝達経路を調節することが観察された。外因性IL-17aは、ASDおよびコントロールNPCの異常な増殖と移動を誘導しなかったが、一方で、これらの細胞におけるシナプスタンパク(シナプトフィシン-1、シナプシン-1)と神経細胞極性蛋白質(MAP2)の発現を有意に増加させた。また、ASDと対照群のNPCは、外因性IL-17aに対して同様の反応を示したことから、神経発達過程において遺伝子-環境相互作用を引き起こすには、IL-17a以外の免疫分子を含むより炎症性の高い環境が必要である可能性も考えられる。結論として、我々の結果は、外因性IL-17aがヒトNPCの神経細胞分化を正に制御することを示唆しており、これは正常な神経細胞とシナプスの発達を妨げ、MIAに関連した脳機能と行動の変化の一因となっている可能性がある。
Keywords: autism spectrum disorder; induced-pluripotent stem cell-derived neural progenitor cells; interleukin-17a; maternal immune activation; neuronal differentiation.
Introduction
自閉症スペクトラム障害(ASD)の遺伝的伝播に関する強力な証拠に加え、脳の発達の重要な時期に環境リスク因子にさらされることもASDのリスクに影響する可能性がある。母体免疫活性化(MIA)への出生前の曝露は、ASDの環境リスク因子として示唆されている。いくつかの疫学研究では、妊娠中に胎児が母体の感染にさらされることで、ASD発症の可能性が高まることが示唆されている(Wilkersonら、2002;Atladóttirら、2010;Brownら、2014;Leeら、2015)。この考え方を裏付けるように、動物モデルでは、免疫原(ウイルス感染を模倣するための合成二本鎖RNAであるポリI:Cなど)を介して実験的に誘発されたMIAは、ASDを思わせる皮質奇形、行動症状、免疫機能障害を持つ子孫をもたらすことが示されている(Smithら、2007;Abrahams and Geschwind、2010;Hsiaoら、2012;Malkovaら、2012;Choiら、2016;Lombardoら、2018)。
最近の研究では、MIAに関連するASD様表現型における母親のインターロイキン-17a(IL-17a)の重要な役割が指摘されている。IL-17aは、主にTヘルパー17(Th17)リンパ球によって産生される炎症性サイトカインであり、通常は自然免疫シグナル伝達に関連する炎症性遺伝子発現をアップレギュレートし、その調節異常が慢性炎症につながる可能性がある(Gaffen, 2009; Amatya et al.) ASDのMIAマウスモデルにおいて、胚12.5日目(E12.5)に妊娠中の胎仔にpoly (I:C)を注射すると、母体血清と胎盤におけるIL-17a発現が強く増加し、胎児脳の皮質におけるIL-17a受容体サブユニットA(IL17RA)発現が増大し、胎児脳と成体脳の両方で層状細胞構造の異常が生じ、ASD関連行動につながった(Choi et al、 2016; Kim et al., 2017; Yim et al., 2017; Lammert et al., 2018)。重要なことに、MIAが存在しないE14.5の胎児脳室に組換えIL-17aを直接注入しても、同様の病理所見が得られた(Choiら、2016)。さらに、妊娠期間中、継続的にIL-17aに胎仔を慢性曝露すると、ASDに関連する神経発達や行動の表現型も生じることが示された(Gumusogluら、2020)。さらにヒトでは、IL17A遺伝子のコピー数の異常変異(van der Zwaagら、2009年)とIL-17aの血清レベルの上昇(Suzukiら、2011年;Al-Ayadhi and Mostafa、2012年;Akintundeら、2015年)がASD被験者で観察された。
脳内では、IL17RAは様々な種類の細胞で発現しており、マウスモデルを用いたこれまでのin vitroおよびin vivoの研究から、IL17RA/IL-17aシグナル伝達が神経前駆細胞(NPC)に作用を及ぼすことが示されている(Li et al、 2013;TfilinおよびTurgeman、2019)、ニューロン(Liuら、2014;TfilinおよびTurgeman、2019;de Limaら、2020)、アストロサイト(Kosticら、2017)、オリゴデンドロサイト(Wangら、2017)、およびミクログリア(Sasakiら、2020)。しかし、IL-17aがヒトの発達中の脳に影響を及ぼすメカニズムや、IL-17aシグナル伝達によって影響を受けてASD関連の欠損に寄与する特定の細胞タイプについては、まだ十分に解明されていない。また、IL-17aがASDの遺伝的危険因子と相乗的に作用し、脳の異常を悪化させる可能性があるかどうかも、まだ明らかにされていない。ここでは、既知および未知の遺伝的原因によるASD患者、および神経正常対照者から採取した人工多能性幹細胞(iPSC)由来のNPCを用いて、ヒトNPCの増殖、遊走、神経分化に対するIL-17aの直接的な影響を調べるとともに、このサイトカインがNPCの機能を変化させる根本的な遺伝的感受性と協調して作用するかどうかを調べた。
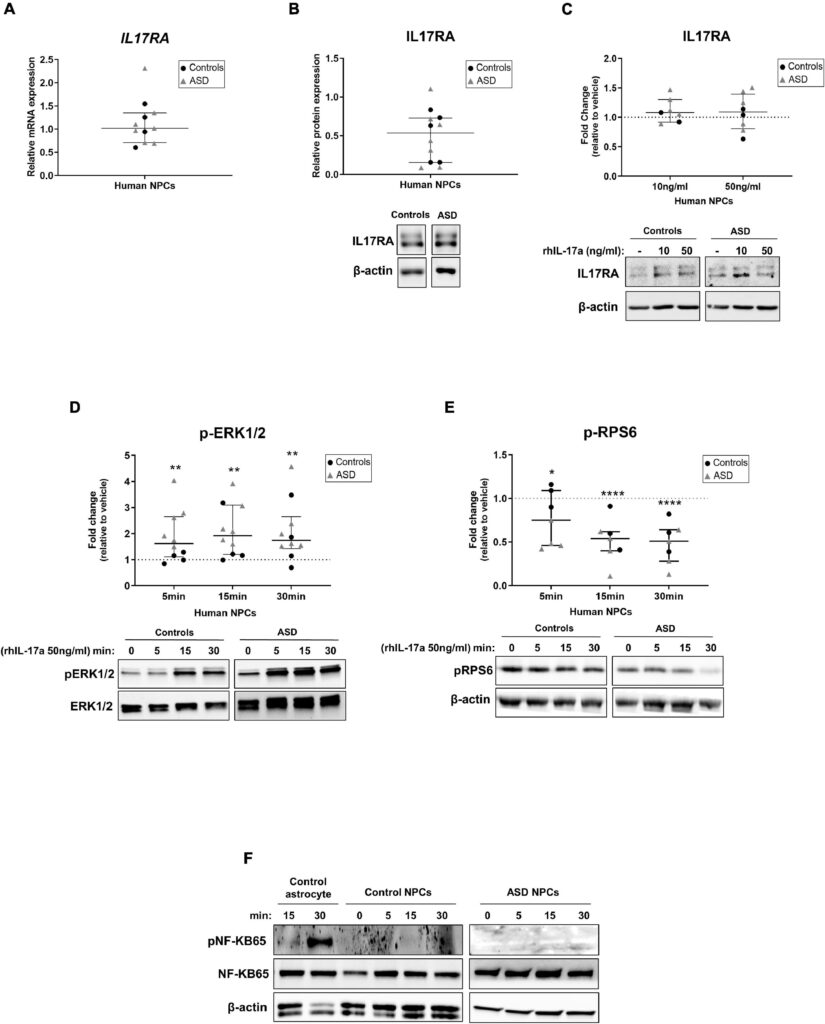
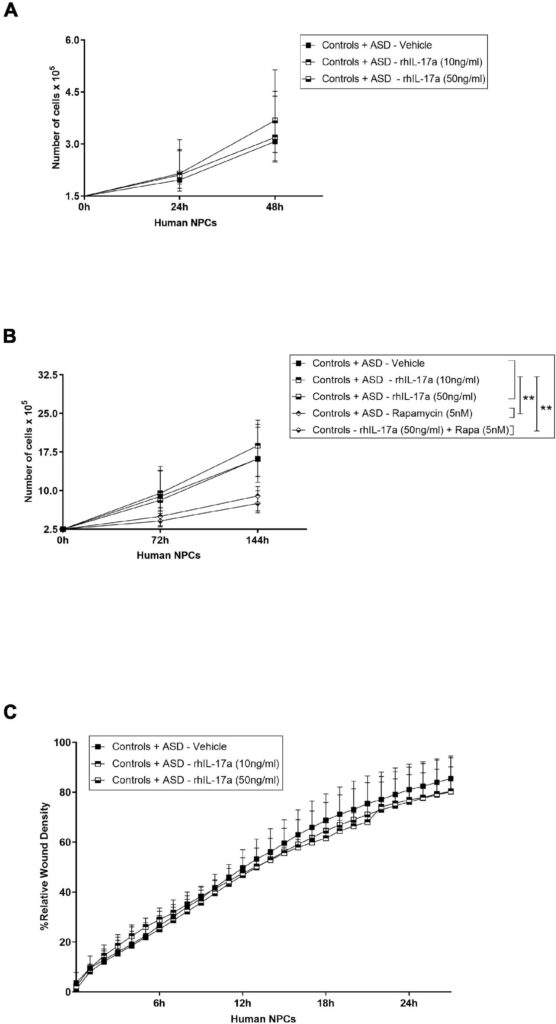
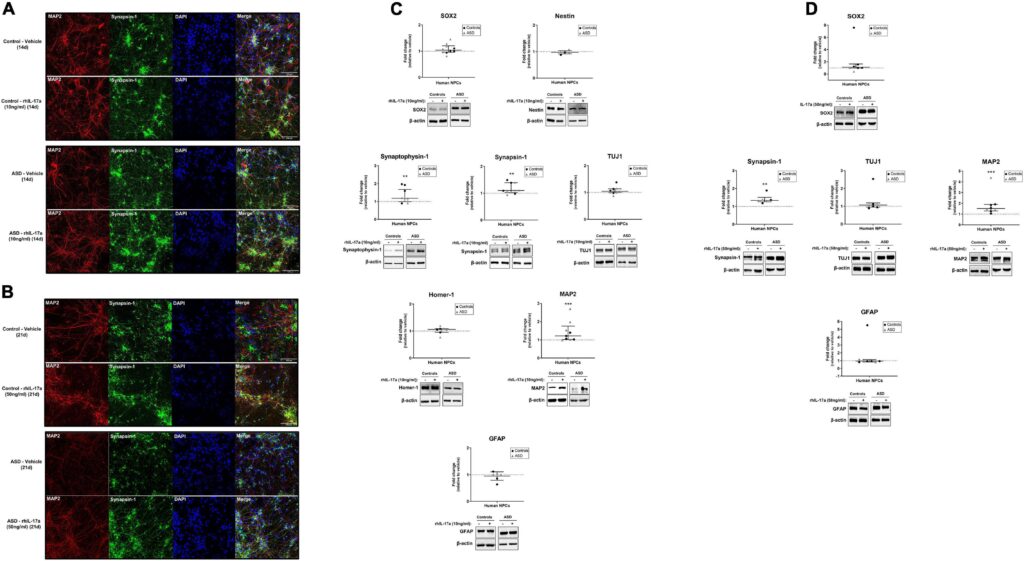
Discussion
本研究の目的は、MIAによって誘発される皮質およびASD様行動異常と関連する主要な炎症性サイトカインであるIL-17aが、ヒト神経前駆細胞NPCの生物学に影響を及ぼし、ASDの遺伝的リスク因子と相乗的にNPCの反応を変化させる可能性があるかどうかを調べることである。NPCは多能性前駆細胞であり、自己複製が可能で、中枢神経系の3つの主要な細胞、すなわちニューロン、アストロサイト、オリゴデンドロサイトを生成する能力を持つ(Anderson, 2001)。ヒトiPSC由来のNPCは、ASDを含む神経疾患のモデルとして用いられてきた(Marianiら、2015;Marchettoら、2017;Griesi-Oliveiraら、2021)、 2021)、我々は最近、自閉症者と対照被験者のiPSC由来NPCからのトランスクリプトーム・プロファイルが、出生前脳発達の初期(妊娠4~10週後)段階の神経細胞組織を反映していることを示し(Griesi-Oliveira et al.)、これらの細胞が神経系の発達とASDの病態生理学に関する重要な手がかりを明らかにできるという考えを裏付けている。
ここでわれわれは、ASDと対照被験者からのiPSC由来NPCはIL-17aを合成・分泌しないが、IL17RA mRNAとタンパク質を発現することを証明した。これらの知見は、生理学的(Liuら、2014)および病理学的(Linら、2016)両方の条件下で、アストロサイトがIL-17aの主な局所的供給源であること、および海馬NPCがIL17RAを発現していること(Liら、2013;Liuら、2014)を示すマウスモデルでの先行研究と一致しており、IL-17aが局所的および全身性の両方でこれらの細胞に直接的な影響を及ぼし得ることを示している。また、ASDおよびコントロール由来の神経前駆細胞NPCを組換えIL-17aで処理してもIL17RAの発現には影響がなかったことから、未分化NPCはMIA時に脳で観察されるIL17RA発現上昇の細胞源ではないことが示唆された(Choi et al.) この観察と一致して、以前の研究では、Pax6陽性の神経前駆細胞ではなく、Ank3陽性およびNeuN陽性の有糸分裂後の神経細胞が、MIA誘導時にマウス胎児脳で高レベルのIL17Raを発現する主要な細胞集団であることが示された(Yim et al.)
我々は、ASDおよび対照被験者由来のNPCにおいて、IL-17a/IL17RAシグナル伝達がERK1/2経路を有意に活性化し、mTORC1経路を阻害することを観察した。IL-17aが介在するシグナル伝達のERK1/2およびmTORC1カスケードがヒトNPCに及ぼす機能的影響はまだ不明であり、さらなる調査に値するが、IL-17aがERK1/2経路の活性化を介してオリゴデンドロサイト前駆細胞の分化を刺激すること(Rodgersら、2015)、およびmTORC1経路を阻害することによって虚血神経細胞におけるオートファジーを増強すること(Liuら、2019)が先行研究で示されていることは注目に値する。したがって、我々の結果は、ERK1/2およびmTORC1経路がヒトNPCにおけるIL-17aの下流標的であり、IL-17aが誘導するこれらの細胞の異常な表現型に関連している可能性を示唆している。
また、外因性IL-17a単独では、ASDおよびコントロール由来の神経前駆細胞NPCの増殖に影響を及ぼさないことも示された。NPCの増殖に対するIL-17aの影響については、マウスモデルでの研究でも議論のある結果が得られている。IL-17aがin vitroにおけるマウスNPCの増殖を負に制御すること(Li et al、 2014)、別の研究では、このサイトカインは脳卒中回復中の脳室下帯NPCの増殖を変化させず、代わりにin vivoでの生存を増加させることが示唆されている(Linら、2016)。したがって、これらの知見を総合すると、NPCの増殖に対するIL-17aの効果は、種や状況に依存するようであり、さらに検討する必要があることが示唆される。
マウスの胎児脳に組換えIL-17aを投与すると、層状の細胞構造に異常が生じることが示されている(Choi et al. しかしながら、IL-17aが誘導する異常な遊走を伴う特定の細胞集団については、まだ十分に解明されていない。われわれの実験条件下では、外因性IL-17a単独ではASD由来およびコントロール由来のNPCの遊走に影響を及ぼさなかったことから、この病的過程におけるIL-17aの主な標的は、未分化のNPCではなく、遊走性の神経芽細胞、成熟神経細胞および/またはグリア細胞ではないかと推測される。興味深いことに、マウス胚にIL-17aを脳室内投与すると、皮質ミクログリアの異常な遊走と活性化が起こることも示されており(Sasaki et al., 2020)、これらの免疫細胞もIL-17a誘発神経病理学に関与している可能性を示唆している。
最後に、今回の所見から、IL-17aはASDおよび対照被験者由来のNPCの神経細胞分化に有意な正の影響を及ぼすことが示された。IL-17aが神経細胞分化に及ぼす影響を調べた研究はほとんどなく、その結果も文脈依存的である。IL-17aノックアウトマウスは、海馬において神経新生と神経細胞興奮性の亢進を示したこと、またIL-17a欠損NPCはin vitroでニューロンへの分化亢進を示したことが示され、IL-17aは生理的条件下で神経新生と神経細胞分化の制御に負の役割を果たしていることが示唆された(Liu et al.) 一方、マウスNPCを組換えIL-17aで処理すると、in vitroで神経細胞分化が刺激され(Lin et al., 2016)、MAP2陽性神経突起伸長が促進される(Tfilin and Turgeman, 2019)という報告もあり、今回の知見と一致している。興味深いことに、神経突起伸長に対する外因性IL-17aのこの効果は、成体交感神経節後神経節ニューロン(Chisholmら、2012年)や成体後根神経節感覚ニューロン(Habashら、2015年)でも報告されている。
また、十分な統計的検出力を持ち、効果的に結論を導き出すためには、より大きなサンプルサイズが必要であるが、IL-17a処理に対するASD由来NPCとコントロール由来NPCの間に総体的な違いが観察されなかったことは注目に値する。このことは、ASDに対する感受性の遺伝的要素が、ヒトNPCの増殖、遊走、神経分化における外因性IL-17aの効果を、我々の実験条件下では変化させなかったことを示唆しているのかもしれない。これまでの研究では、結節性硬化症複合体モデルマウス(Ehningerら、2012年)やPTEN関連自閉的行動・巨頭症モデルマウス(Le Belleら、2014年)において、MIAとASDの遺伝的危険因子の相互作用が示されている。興味深いことに、PTEN変異体子孫で観察されたより顕著な脳の過成長は、NPCの増殖亢進によるところもあった(Le Belleら、2014)。したがって、IL-17a以外の生体分子を含む炎症環境が、自閉症児の神経発達における遺伝子-環境相互作用の引き金になる可能性がある。
結論として、我々の結果は、外因性IL-17aがヒトNPCの神経細胞分化を刺激し、正常な神経細胞とシナプスの発達を妨げ、母体免疫活性化MIAによる脳と行動の変化に関与している可能性を示唆している。
