Cell Volume 186, Issue 18, 31 August 2023, Pages 3845-3861.e24

The projection-specific signals that establish functionally segregated dopaminergic synapses (機能的に分離されたドーパミン作動性シナプスを確立する投射特異的シグナル)
Akiko Terauchi 1, Patricia Yee 1, Erin M. Johnson-Venkatesh 1, Mariel P. Seiglie 1, Lisa Kim 1, Julia C. Pitino 1, Eli Kritzer 1, Qiyu Zhang 2, Jie Zhou 3, Yulong Li 4, David D. Ginty 2, Wei-Chung A. Lee 1, Hisashi Umemori 15
1Department of Neurology, F.M. Kirby Neurobiology Center, Boston Children’s Hospital, Harvard Medical School, Boston, MA 02115, USA2Department of Neurobiology and Howard Hughes Medical Institute, Harvard Medical School, Boston, MA 02115, USA3Department of Computer Science, Northern Illinois University, DeKalb, IL 60115, USA4State Key Laboratory of Membrane Biology, PKU-IDG/McGovern Institute for Brain Research, Peking-Tsinghua Center for Life Sciences, Peking University, Beijing 100871, China
Received 10 August 2022, Revised 28 May 2023, Accepted 14 July 2023, Available online 16 August 2023, Version of Record 31 August 2023.
Highlight
•アンバイアスな検索により、投射特異的なドーパミン作動性シナプスオーガナイザーが特定された。
•BMP6/2 – Smad1 および TGF-β2 – Smad2 軸は黒質線条体シナプスと中脳辺縁系シナプスを確立する。
•BMP6、BMP2、および TGF-β2 は相乗作用または拮抗してドーパミン作動性シナプスを確立する。
•Smad1 変異マウスは運動障害を示し、Smad2 変異マウスは意欲の欠如を示す。
Summary
ドーパミン作動性投射は様々な脳機能を制御し、多くの精神神経疾患に関与している。中脳と線条体をつなぐドーパミン作動性投射には、運動を制御する黒質投射と、意欲を制御する中脳辺縁投射の2つがあり、解剖学的にも機能的にも区別されている。しかし、これらの別々のドーパミン作動性シナプス結合がどのようにして確立されるのかは不明である。われわれは、バイアスのない探索により、2つの拮抗的なTGF-βファミリーメンバー、骨形成タンパク質(BMP)6/BMP2とトランスフォーミング成長因子(TGF)-β2が、それぞれ黒質ニューロンと中脳辺縁ニューロンのドーパミン作動性シナプス形成を制御していることを明らかにした。これらの受容体の投射優先的発現は、特異的なシナプスの発達に寄与している。下流では、Smad1とSmad2が特異的に活性化され、黒質投射と中脳辺縁投射におけるドーパミン作動性シナプスの発達と機能に必要である。驚くべきことに、Smad1変異マウスは運動障害を示すが、Smad2変異マウスは意欲の欠如を示す。これらの結果は、機能的に分離されたドーパミン作動性シナプスの適切な確立の根底にある分子論理を明らかにし、特定のBMP/TGF-βやSmadを標的とすることで、関連する投射に特異的な疾患症状を治療する戦略を提供するかもしれない。
Graphical Abstract
Keywords
dopamine, synapse development and function, nigrostriatal and mesolimbic dopaminergic projections, BMP vs. TGF-β signaling, bone morphogenetic protein vs. transforming growth factor β signaling, Parkinson’s disease, schizophrenia and depression
Introduction
中脳から線条体へのドーパミン作動性経路は、多くの脳機能において重要な役割を果たしている1。これらの経路の機能不全は、薬物中毒、注意欠陥・多動性障害(ADHD)、統合失調症、うつ病、パーキンソン病など、多くの精神・神経疾患と関連している。解剖学的および機能的に、中脳から線条体へのドーパミン作動性接続は、黒質経路と中脳辺縁系経路という2つの別個の経路に分類される。黒質経路は、黒質小体(SNc)から背側線条体(尾状核[CPu])へドーパミン作動性シグナルを伝達する。一方、中脳辺縁系経路は、腹側被蓋野(VTA)から腹側線条体(側坐核[NAc])へドーパミン作動性シグナルを伝達する。したがって、脳の最適な機能のためには、これらの異なる経路のドーパミン作動性シナプス結合が、発生の過程で特異的に確立されていなければならない。適切なドーパミン作動性接続が確立される方法と分子を理解することで、ドーパミン作動性経路の欠陥に関連する精神神経疾患の病因と治療の両方について、新たな知見が得られるかもしれない。そのため、ドーパミン作動性シナプス結合の確立を制御する因子やメカニズムを解明することに強い関心が寄せられている。
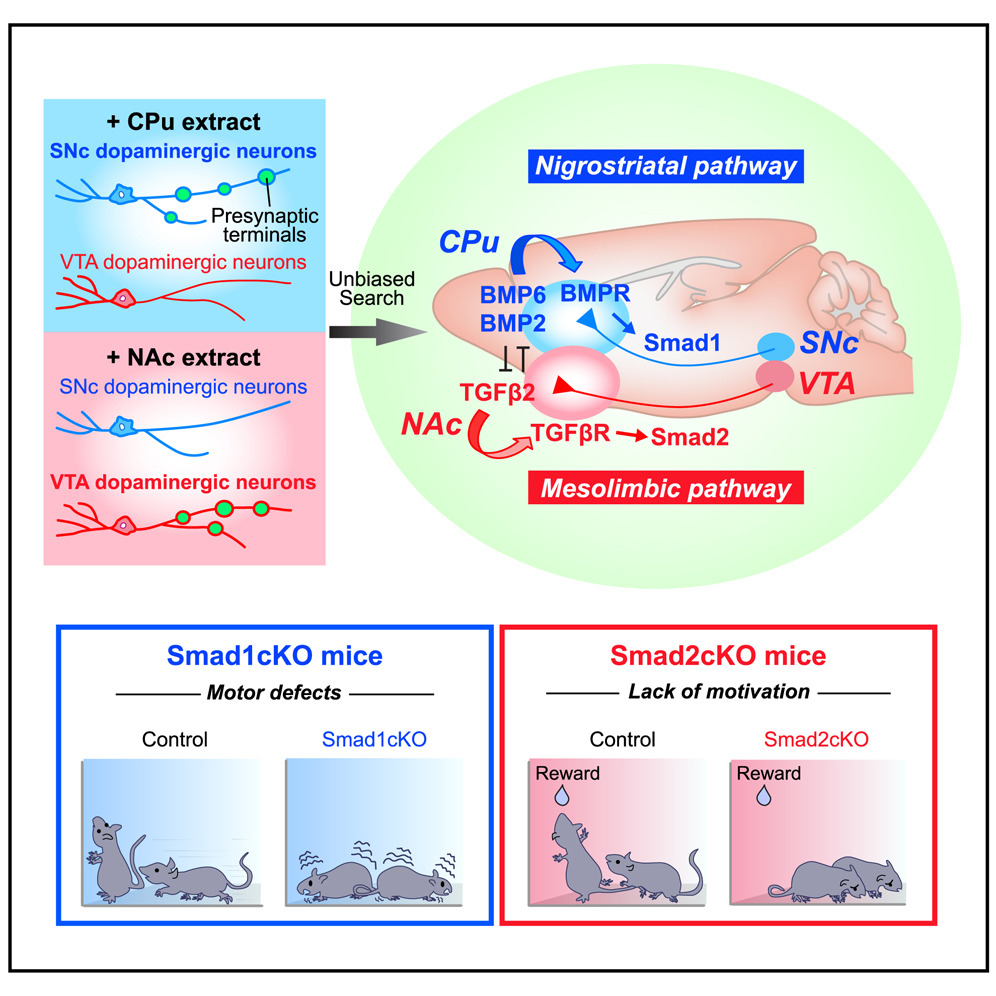
ここでは、ドーパミン作動性シナプスの発達の特徴を明らかにし、アンバイアスな検索を行うことで、2つの標的由来のトランスフォーミング成長因子β(TGF-β)ファミリーメンバー、骨形成タンパク質(BMP)6/BMP2およびTGF-β2が、それぞれ黒質ニューロンおよび中脳辺縁系ニューロンにおけるドーパミン作動性シナプスの発達を制御していることを同定した。さらに、BMP6、BMP2、およびTGF-β2は、適切なドーパミン作動性シナプスを確立するために、相乗作用または拮抗作用を示すことも示した。BMP受容体(BMPR)とTGF-β受容体(TGF-βR)の経路選択的発現もまた、特異的なドーパミン作動性シナプス形成に寄与している。最後に、Smad1とSmad2という異なるシグナル伝達分子が特異的に活性化され、黒質または中脳辺縁系におけるドーパミン作動性シナプスの発達と機能に必要であることを示す。Smad1変異マウスは運動障害を示し、Smad2変異マウスは意欲の欠如を示すことから、それぞれの経路に関連する行動の基盤となる機能的シナプスの確立において、Smad1とSmad2のシグナル伝達が重要であることが明らかになった。この結果は、パラレルではあるが機能的には別々のドーパミン作動性経路を確立するために利用されている分子論理を明らかにするものである。
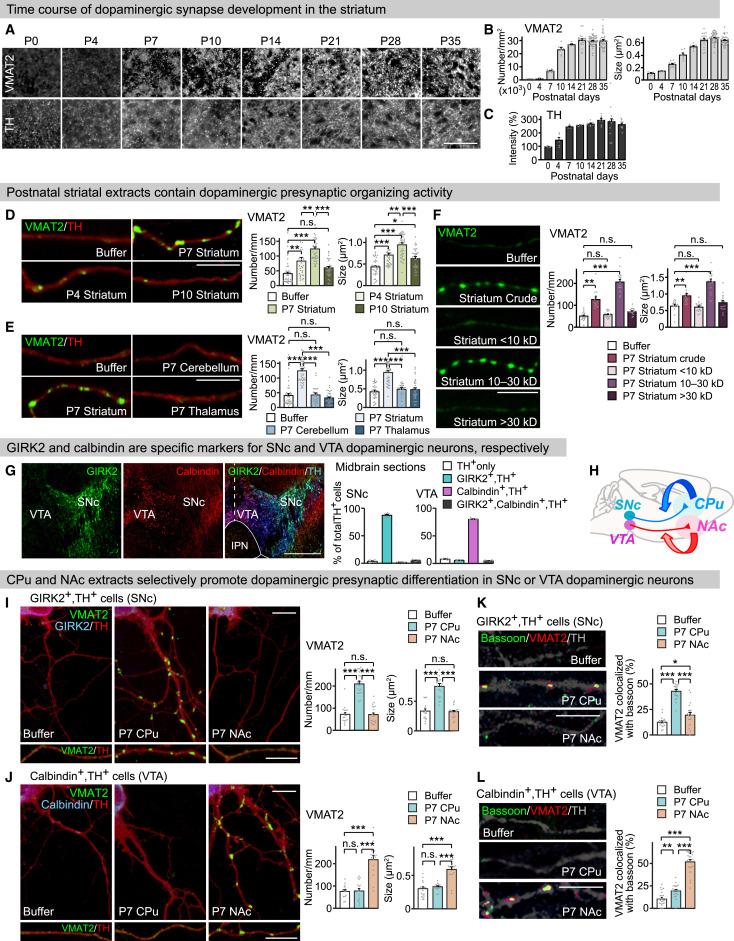
(A–C) Time course of dopaminergic synapse development in the rat striatum. Presynaptic differentiation and targeting of dopaminergic axons were monitored by VMAT2 and TH immunostaining, respectively. (A) Representative images. Scale bar, 50 μm. (B) Quantification of the density and size of VMAT2 puncta. (C) Quantification of TH immunoreactivity (relative to P0). n (fields; rats) = 5–45; 3–10 (B) and 5–11; 3–7 (C).
(D–F) Characterization of dopaminergic presynaptic organizing activity. Cultured midbrain neurons were treated with each extract at 4 DIV (days in vitro) and stained at 6 DIV for TH and VMAT2. (D) Age-dependent effects of striatal extracts on dopaminergic presynaptic differentiation. (E) Dopaminergic presynaptic organizing activity is specific to the striatal extract. (F) The molecular size of the dopaminergic presynaptic organizers is 10–30 kDa. Scale bars, 10 μm. n (cells; independent experiments) = 20–39; 6–7 (D), 29–39; 7–8 (E), 13–16; 3 (F), one-way ANOVA with Tukey’s test.
(G) GIRK2 and calbindin are markers for SNc or VTA dopaminergic neurons. P14 mouse coronal sections were immunostained for GIRK2, calbindin, and TH. Dashed line: midline; IPN, interpeduncular nucleus. Scale bar, 500 μm. n (sections; mice) = 8; 4.
(H) Illustration of the nigrostriatal (SNc to CPu) and mesolimbic (VTA to NAc) dopaminergic pathways. We hypothesize that CPu and NAc provide specific molecules that promote dopaminergic presynaptic differentiation in SNc and VTA mDA neurons, respectively.
(I and J) CPu and NAc extracts selectively promote VMAT2 clustering in SNc or VTA dopaminergic neurons, respectively. Midbrain cultures were treated at 4 DIV with the extract and stained at 6 DIV. Scale bars, 10 μm. n (cells; independent experiments) = 16–18; 4 (I), 16–18; 5 (J), one-way ANOVA with Tukey’s test.
(K and L) CPu and NAc extracts preferentially promote bassoon clustering at dopaminergic presynaptic terminals in SNc or VTA dopaminergic neurons, respectively. Scale bars, 10 μm. n (cells; independent experiments) = 20; 4 (K), 24; 3–4 (L), one-way ANOVA with Tukey’s test.
Data are represented as mean ± SEM.
運動機能、情動、意欲、報酬関連におけるドーパミン作動性経路の重要性や、多くの疾患への関与はよく知られているにもかかわらず、ドーパミン作動性シナプス形成についてはほとんどわかっていない。ここで我々は、ドーパミン作動性シナプスは、互いに拮抗するシグナル伝達経路を持つ異なる標的由来因子によって、経路特異的に樹立されることを示した。我々は、黒質突起の組織化経路としてBMP6/2-BMPR-Smad1軸を、中脳辺縁系突起の組織化経路としてTGF-β2-TGF-βR-Smad2軸を同定した(図6L)。mDAニューロンにおけるSmadの生後不活性化は、それらの生存、軸索標的化、樹状突起の発達、およびそれらに形成されるシナプスに影響を与えなかったことから、生後、Smadシグナル伝達はドーパミン作動性シナプス前分化に特に重要であることが示された。興味深いことに、TGF-βシグナル伝達の胎生期の不活性化は、mDAニューロンの生存、樹状突起の成長、樹状突起上のシナプスに影響を及ぼす。加えて、BMP/TGF-βシグナルは局所的かつグローバルに作用することが知られており、これがシナプス特異的でコンパートメント化された効果に寄与している可能性がある。
BMP6/BMP2とTGF-β2による効果の特異性は、複数のレベルで達成されている。(1)BMP6/BMP2とTGF-β2は、それぞれCPuとNAcで優先的に発現していること、(2)それらの受容体であるBMPRとTGF-βRは、黒質または中脳辺縁系ニューロンで優先的に発現していること、(3)黒質経路と中脳辺縁系経路のドーパミン作動性シナプス前発達を、それぞれ異なるSmadsが仲介していること。本研究の興味深い点は、BMP-Smad1シグナル伝達経路とTGF-β-Smad2シグナル伝達経路は、互いに拮抗することが知られていることである16。実際、SNcニューロンにおけるドーパミン作動性シナプス前分化に対するBMP6/2の作用はTGF-β2によって抑制され、VTAニューロンにおけるドーパミン作動性シナプス前分化に対するTGF-β2の作用はBMP6/2によって抑制されることから、黒質経路と中脳辺縁系経路の特異的な分離が強化されている可能性がある。BMP3もまた、この特異性を高める役割を果たしているのかもしれない。Bmp3遺伝子はCPuよりもNAcで多く発現している(表1)。BMP3はBMPRに結合できるがシグナルを発しないというユニークなBMPである53。したがって、NAcに発現しているBMP3はBMP6/BMP2(黒質ドパミン作動性オルグ)に対するアンタゴニストとして作用し、中脳辺縁系経路に対する特異性を高める可能性がある。また、BMPは互いに相乗的に作用する可能性もある。実際、BMP6/2ヘテロ二量体は、SNcドーパミン作動性ニューロンのVMAT2クラスタリングを、ホモ二量体のどちらか一方よりも強く誘導することがわかった。従って、複数のBMP/TGF-βシグナルが拮抗あるいは相乗することによって相互作用し、適切なドーパミン作動性投射を確立しているようである。
以前の研究では、ニューロリギン-2がGABA作動性シナプスとドーパミン作動性シナプスのバランスを制御している可能性が示唆されている。したがって、BMP6/BMP2/TGF-β2とニューロリギン-2は、順次ドーパミン作動性シナプスの発達を制御することによって協調的に働くのかもしれない。BMP6/BMP2/TGF-β2によってドーパミン作動性シナプス前末端が誘導された後、ニューロリギン-2はドーパミン作動性シナプスの数を制御するのかもしれない。
ドーパミンの重要性を際立たせているのは、多くの精神神経疾患における中心的役割である。多くの精神刺激薬は中脳辺縁系ドーパミン作動性経路を活性化し、中脳辺縁系経路の変化は統合失調症、ADHD、うつ病、依存症など多くの精神神経疾患に関与している。実際、われわれの行動研究から、Smad1cKOマウスは運動障害を示したが、Smad2cKOマウスは意欲の欠如を示した。したがって、これらのcKOマウスは、神経精神疾患の新しいモデルになるかもしれない。Smadはドーパミン作動性シナプスの発達と維持に関与していることから、Smad1とSmad2を標的とすることで、このような疾患を治療する新たな戦略をデザインできる可能性が示唆された。BMP-Smad1またはTGF-β-Smad2の適切な適用または遮断は、ドーパミン作動性シナプスの異常を伴う神経精神疾患を治療するために、ドーパミンレベルを経路特異的に調節する可能性がある。
