IL-17A Alters Human Cortical Development in a 3D Ex Vivo Model of Maternal Immune Activation (IL-17Aは母体免疫活性化の3D Ex Vivoモデルにおいてヒト大脳皮質の発達を変化させる)
Muhammad Z. K. Assir, Mario Yanakiev, Do Hyeon Gim, Sara S. M. Valkila, Paola Muscolino, Liu Peng, Paul A. Fowler, Daniel A. Berg, Eunchai Kang
School of Medicine, Medical Sciences and Nutrition, Institute of Medical Sciences, University of Aberdeen, UK
アバディーン大学は、1495年に設立された古大学 (ancient university) を前身とし、スコットランドでは3番目、現在の英国および英語世界で5番目に長い歴史をもつ。スコットランドの四大学(ほかにエディンバラ、グラスゴー、セントアンドリュースの三大学)の一つである。現代のアバディーン大学は、オールド・アバディーンのキングス・カレッジ (King’s College) と、1593年にニュー・アバディーンに創立されたマーシャル・カレッジ (Marischal College) の統合により1860年に形成された (Wikipedia)。
要約
ヒトの脳の発達は、多様な細胞タイプと細胞外マトリックス(ECM)成分の協調的な相互作用に依存しており、これらは適切な神経発生と皮質組織化に不可欠です。疫学的研究と動物実験は、母体の免疫活性化(MIA)が脳の発達を障害し、神経発生の障害と神経発達障害(NDDs)のリスク増加を引き起こすことを示しています。これには自閉症スペクトラム障害(ASD)や統合失調症が含まれます。しかし、MIAがヒト皮質発達に及ぼす細胞的・分子メカニズムは依然として不明な点が多い。本研究では、ヒト胎児脳組織の背外側前頭前野から由来する3次元ex vivo培養系「cerebroids」を提案する。この系は、発達過程の主要なプロセス、発達中のヒト皮質の重要な細胞多様性および構造的整合性を忠実に保持している。このプラットフォームを用いて、NDDsと強く関連するサイトカインであるIL-17Aが、皮質折り畳みの早期化、皮質厚の増加、神経発生と神経細胞の成熟の加速を引き起こすことを示しました。トランスクリプトーム解析とプロテオーム解析は、ECM関連経路の著しい異常調節を明らかにし、特にブレビカンやベルシカンなどのプロテオグリカンの発現上昇が観察されました。注目すべきは、NF-κBおよびHDAC1経路の阻害剤である抗炎症剤パルテノライドの投与が、IL-17A誘発性皮質異常を逆転させ、正常な皮質厚さ、折り畳み、および神経発生を回復させることです。これらの結果は、MIAにおけるIL-17Aがヒト皮質発達をどのように障害するかを解明し、NDD関連構造的皮質異常の理解を深める貴重な知見を提供します。
Methods
ヒト胎児脳(妊娠11〜14週)からDLPFC領域を切り出し、振盪培養により3D cerebroidを作成。IL-17Aを添加し、免疫染色、RNA-seq、プロテオーム解析、電子顕微鏡観察などを実施。parthenolideによる介入実験も行った。
Results
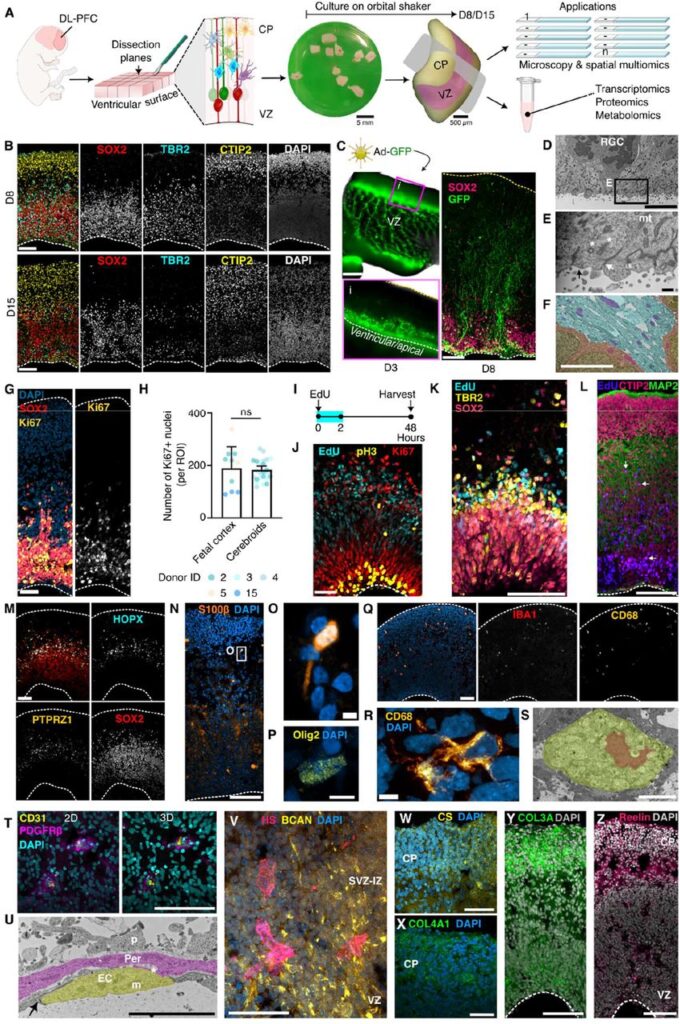
- 3D培養系cerebroidsの確立と特性評価
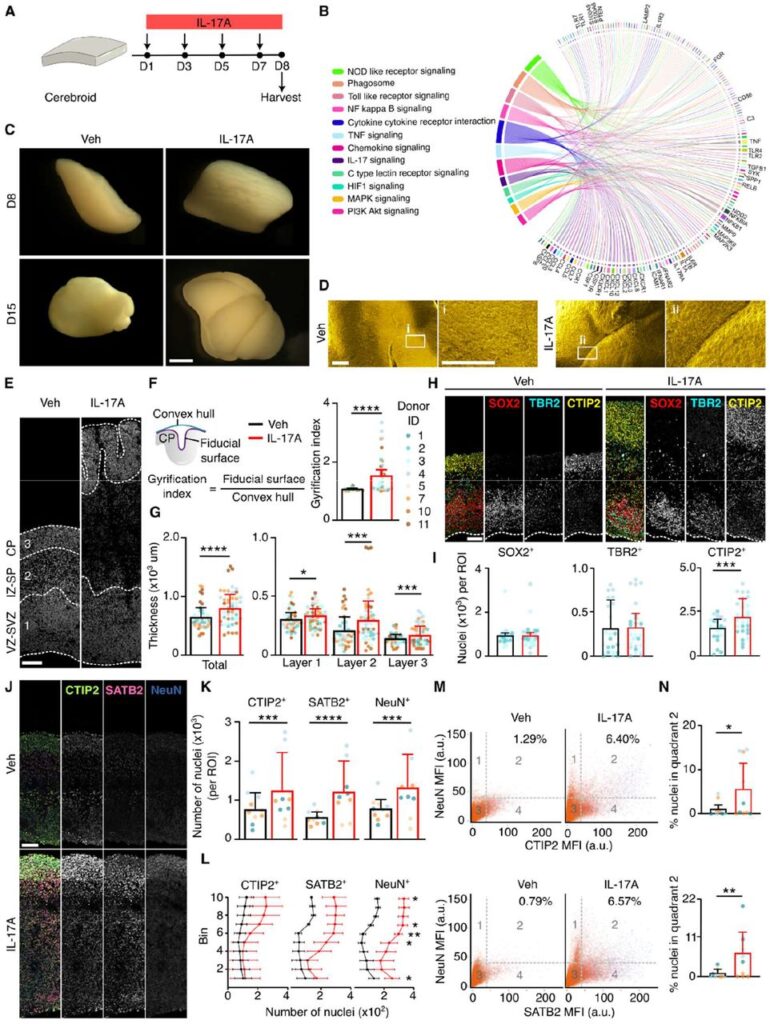
胎児期(妊娠11–14週)のヒト前頭前皮質(DLPFC)組織を使用して、構造的完全性を保持した10 mm²の組織断片を作成し、揺動培養。8日および15日後のcerebroidsで、SOX2⁺ NSC、TBR2⁺中間前駆細胞(IPC)、CTIP2⁺ニューロンの層構造が再現された。SEMやTEMにより細胞極性やアピカル接着構造の維持が確認され、細胞種(NSC、oRG、ニューロン、グリア、マイクログリア、血管内皮細胞、ペリサイト)やECM成分(ヘパラン硫酸、コンドロイチン硫酸、Reelinなど)も保持された。 - IL-17Aによる皮質発達異常の誘導
IL-17A処理により以下の変化を観察:
- 皮質の早期折り畳み(gyrification indexの増加)
- 皮質全体の厚み増加(層1: VZ/SVZ, 層2: IZ/SP, 層3: CPすべてで増加)
- CTIP2⁺深層ニューロン、SATB2⁺上層ニューロン、NeuN⁺成熟ニューロンの数が有意に増加
- IL-17Aは神経成熟促進を伴う神経発生促進を誘導 - 神経発生の促進メカニズム
EdU pulse-chase実験により、CTIP2⁺ニューロンおよびTBR2⁺ IPCsの新生増加を確認。SOX2⁺ NSCのEdU陽性率には差がなく、Ki67⁺細胞数も同等だったが、EdU⁺Ki67⁺細胞はIL-17A群で増加。すなわち細胞周期再進入が増加し、増殖維持下で神経分化が促進された。iPSC由来のオルガノイドやNPCでも同様のCTIP2⁺やMAP2⁺ニューロンの増加が観察され、IL-17Aは直接NSCに作用することが示唆された。 - ECMリモデリングの分子基盤
RNA-seqおよびプロテオーム解析により、以下が明らかに:
- 共通して変化した経路:HDAC/エピジェネティック制御、NF-κB、ECM糖鎖修飾、代謝、WNTシグナル
- NLCCsではECM再構築関連遺伝子(THBS2, COL4A2, LAMA2など)が上昇
- プロテオーム解析ではBCAN(brevican)およびVCAN(versican)が上昇(iECM画分)
- コルチカルフォールディング部位でコンドロイチン硫酸の増加
- TEMでプロテオグリカンの蓄積が確認された - パルテノライド(PTL)による異常の是正
NF-κBおよびHDAC1経路を標的とするPTLをIL-17Aと同時投与したところ:
- 皮質折り畳み(GI)と厚みの異常が正常化
- CTIP2⁺、SATB2⁺、NeuN⁺ニューロンの過剰が抑制
- VZにおけるBCAN発現も正常化
➡ NF-κBおよびHDAC1経路がIL-17Aによる異常の主要因であることが示唆された
Discussion
- 本研究で開発されたcerebroidモデルは、細胞極性・多様性・ECM構成・免疫・血管要素を含むヒト皮質発達の再現に成功し、環境因子(MIA)の影響を評価する高精度モデルである。
- IL-17Aは、NSCに直接作用して神経発生と成熟を促進し、皮質構造の異常(厚み・折り畳み)を誘導。これらは自閉スペクトラム症(ASD)で観察されるマクロセファリー、ニューロン数増加、過剰折り畳みと一致している。
- ECM構造の変化が皮質異常に重要な役割を果たし、BCAN/VCANの増加とそれらのハイアルロン酸との結合が、皮質折り畳みの引き金となる可能性がある。
- IL-17Aは多細胞型におけるECMの再構築を誘導し、その機序の解明が今後の課題である。
- PTLによる異常の抑制は、NF-κB/HDAC1経路が主要な制御因子であることを示唆し、治療標的の候補となり得る。
- 現時点では性差の影響や長期培養による評価は未実施である。