Nat Commun. 2024 Dec 30;15(1):10819. doi: 10.1038/s41467-024-55050-y.
A high-protein diet-responsive gut hormone regulates behavioral and metabolic optimization in Drosophila melanogaster (高タンパク質食応答性腸ホルモンによるキイロショウジョウバエの行動および代謝最適化の調節)
Yuto Yoshinari 1 2, Takashi Nishimura 3, Taishi Yoshii 4, Shu Kondo 5 6, Hiromu Tanimoto 7, Tomoe Kobayashi 8, Makoto Matsuyama 8, Ryusuke Niwa 9
Metabolic Regulation and Genetics, Institute for Molecular and Cellular Regulation, Gunma University, Maebashi, Japan. yuto.yoshinari@gunma-u.ac.jp.
Life Science Center for Survival Dynamics, Tsukuba Advanced Research Alliance (TARA), University of Tsukuba, Tennodai 1-1-1, Tsukuba, Ibaraki, 305-8577, Japan. ryusuke-niwa@tara.tsukuba.ac.jp.
Abstract
Protein is essential for all living organisms; however, excessive protein intake can have adverse effects, such as hyperammonemia. Although mechanisms responding to protein deficiency are well-studied, there is a significant gap in our understanding of how organisms adaptively suppress excessive protein intake. In the present study, utilizing the fruit fly, Drosophila melanogaster, we discover that the peptide hormone CCHamide1 (CCHa1), secreted by enteroendocrine cells in response to a high-protein diet (HPD), is vital for suppressing overconsumption of protein. Gut-derived CCHa1 is received by a small subset of enteric neurons that produce short neuropeptide F, thereby modulating protein-specific satiety. Importantly, impairment of the CCHa1-mediated gut-enteric neuronal axis results in ammonia accumulation and a shortened lifespan under HPD conditions. Collectively, our findings unravel the crosstalk of gut hormone and neuronal pathways that orchestrate physiological responses to prevent and adapt to dietary protein overload.
概要
キイロショウジョウバエを用いて、高タンパク質食(HPD)による過剰なタンパク質摂取を抑制する腸内分泌ホルモンCCHamide1(CCHa1)の役割を解明した。CCHa1は腸内分泌細胞から分泌され、腸管神経を介して短神経ペプチドF(sNPF)神経へ信号を送る。この連携により、タンパク質特異的な摂取量の調節が行われ、栄養バランスが維持される。CCHa1の欠損によりアンモニアが蓄積し、寿命が短縮することが確認された。この研究は、腸内分泌ホルモンが摂食嗜好性と代謝バランスに及ぼす新たなメカニズムを示している。
背景
動物は体内の栄養状態を感知し、欠乏している栄養素を補うように摂食行動を調節する。しかし、特定の栄養素の過剰摂取を防ぐメカニズムは十分に理解されていない。特にタンパク質に関しては、「タンパク質レバレッジ仮説」に基づき、不足時には摂取が促進され、過剰時には抑制されると考えられている。ショウジョウバエは、体内の栄養需要に応じて餌を選択する特性を持つ。例えば、糖のみを摂取した個体や、多くの卵を産む必要があるメスは、タンパク質を多く含む餌を選択する。このような行動の背後にある分子メカニズムを明らかにすることが今回の研究の目的である。
方法
- 腸内分泌ホルモンの特定
RNA干渉法(RNAi)を用いて腸内分泌ホルモンの遺伝子をノックダウンし、摂食量をCAFÉアッセイ(capillary feeder assay)で測定した。CCHa1遺伝子のノックダウンにより摂食量の増加が確認された。 - 摂食嗜好性の解析
二択アッセイにより、CCHa1欠損個体がタンパク質摂取を過剰に行うことを示した。さらに、短時間摂食測定システム(FlyPAD)で摂食行動の変化を詳細に解析した。 - 腸内分泌細胞の活性化評価
カルシウムイメージング(CaLexA)を用いて、CCHa1産生腸内分泌細胞が高タンパク質食や非必須アミノ酸(アラニンとグリシン)により活性化されることを明らかにした。 - 神経ネットワークの調査
sNPF神経と隣接する甘味受容神経(Gr43a神経)の関与を解析し、これらが摂食調節に重要であることを確認した。 - 代謝と寿命への影響
液体クロマトグラフィー-質量分析(LC-MS/MS)を用いて代謝物プロファイルを測定し、アンモニアの蓄積が寿命に与える影響を評価した。
結果
- CCHa1の役割
CCHa1は腸内分泌細胞から分泌され、sNPF神経を活性化することで、タンパク質特異的な摂食抑制を実現する。これにより過剰なタンパク質摂取が防がれる。 - アンモニア蓄積と寿命短縮
CCHa1が欠損したショウジョウバエでは、高タンパク質食によるアンモニア蓄積が観察され、寿命が短縮した。尿素サイクル中間代謝物の増加も確認され、アンモニア解毒能力の低下が示唆された。 - アミノ酸応答
非必須アミノ酸(アラニンとグリシン)がCCHa1産生細胞を活性化することを明らかにした。 - 神経回路の特定
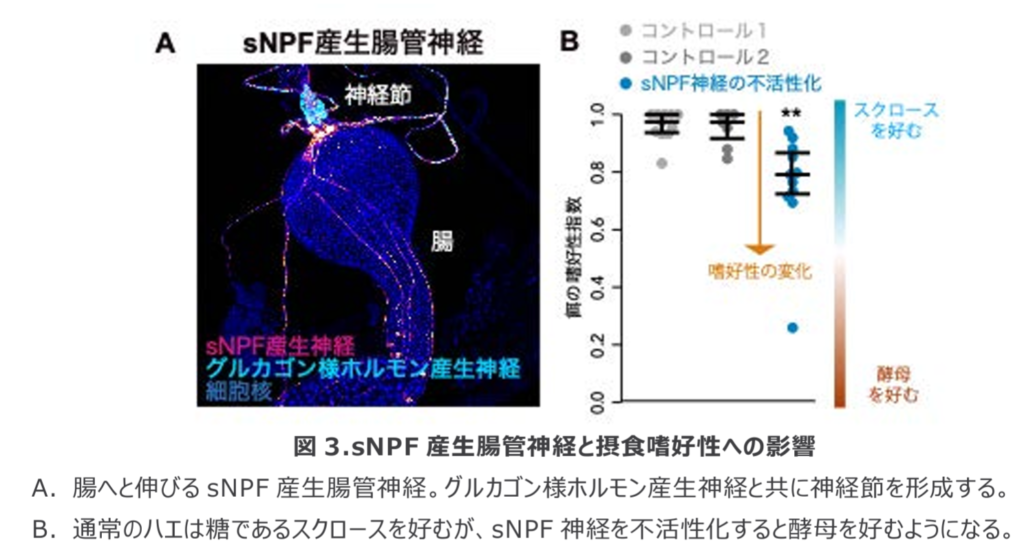
CCHa1信号はsNPF神経を介して甘味受容神経へと伝達され、摂食嗜好性が調節されることが示された。
議論
この研究は、腸内分泌ホルモンと神経ネットワークが協働して摂食嗜好性を調節し、栄養バランスを維持する仕組みを解明した。特に、過剰なタンパク質摂取を防ぐことが、アンモニア蓄積による代謝ストレスの軽減に寄与している。また、性差による摂食嗜好性の違いも観察された。従来の研究が主に栄養不足時の応答に注目していたのに対し、本研究は栄養過剰時の適応メカニズムを初めて明確に示した。また、腸-神経ネットワークによる摂食嗜好性の調節という新しい視点を提供した。
ショウジョウバエを用いた本研究は、高タンパク質食応答性腸ホルモンCCHamide1(CCHa1)の役割を解明したが、この知見をヒトに外挿するにはいくつか考慮が必要である。第一に、CCHa1は無脊椎動物で広汎に保存されたホルモンであるが、ヒトにおいて対応するホルモンが確認されていないため、直接的な外挿は慎重に行う必要がある。また、ショウジョウバエの腸-神経ネットワークは単純であるのに対し、ヒトでは腸管神経系(ENS)や腸-脳軸が複雑に発達しており、多様なホルモンや神経伝達物質が関与する。そのため、CCHa1のようなホルモンがヒトにおいて同様に摂食嗜好性を調節するかは不明である。
さらに、非必須アミノ酸(アラニンやグリシン)がCCHa1産生細胞を活性化することが示されたが、ヒトでは非必須アミノ酸の代謝がショウジョウバエに比べてより多岐にわたるため、同様の応答が存在するかどうかを確認する必要がある。腸内分泌ホルモンをターゲットとした治療の応用可能性も、本研究では示唆されたが、ヒトでは腸内細菌叢(マイクロバイオーム)が大きな影響を与えるため、腸ホルモンと腸内細菌との相互作用を詳細に解明する必要がある。また、腸ホルモンを介した摂食制御の破綻がヒトでどのような代謝的影響を及ぼすかについての理解をさらに深める必要があると考えられる。
CCHa1に類似したヒト腸ホルモンを特定し、その摂食調節機能を明らかにすることが重要である。そのためには、哺乳類モデルを用いた研究やヒトを対象とした臨床試験が求められる。特に、腸内分泌ホルモンがヒトの肥満や摂食障害に対してどのような治療的効果を持つかを評価することが課題である。また、腸ホルモンと糖質や脂質などの他の栄養素との相互作用も明らかにし、包括的な栄養摂取制御モデルを構築する必要がある。本研究は、腸内分泌ホルモンを基盤とした新たな栄養関連疾患の治療法開発に向けた一歩として期待される。
