Journal of Neuroscience 19 September 2024, e1137242024; https://doi.org/10.1523/JNEUROSCI.1137-24.2024
Estrous cycle-dependent modulation of sexual receptivity in female mice by estrogen receptor beta-expressing cells in the dorsal raphe nucleus
エストロス周期に依存した雌マウスの性受容性の調節における背側縫線核のエストロゲン受容体β発現細胞
Tomoaki Murakawa, Lisa Kogure, Kakuma Hata, Kansuke Hasunuma, Satoshi Takenawa, Kazuhiro Sano and Sonoko Ogawa
Laboratory of Behavioral Neuroendocrinology, University of Tsukuba, Tsukuba, Japan
Abstract
The sexual receptivity of female mice, shown as lordosis response, is mainly regulated by estradiol action on estrogen receptor alpha (ERα) and beta (ERβ), depending on the day of the estrous cycle. Previous studies revealed that ERα in the ventromedial nucleus of the hypothalamus (VMH) plays an essential role in the induction of lordosis on the day of estrus (Day 1). However, the mechanisms of the transition to non-receptive states on the day after estrus (Day 2) are not completely understood. In the present study, we investigated the possible role of ERβ, which is highly expressed in the dorsal raphe nucleus (DRN), in lordosis expression. We found that ERβ-Cre female mice, which were ovariectomized and primed with estradiol and progesterone to mimic the estrous cycle, showed high levels of lordosis on Day 2 when ERβ-expressing DRN (DRN-ERβ+) neuronal activity was chemogenetically suppressed. This finding suggests that excitation of DRN-ERβ+ neurons is necessary for the decline of lordosis on Day 2. Fiber photometry recordings during female-male behavioral interactions revealed that DRN-ERβ+ neuronal activation in response to male intromission was significantly more prolonged on Day 2 compared to Day 1. Chemogenetic over-stimulation of DRN-ERβ+ neurons induced c-Fos expression in brain areas known to be inhibitory for lordosis expression, even though they did not express anterogradely labeled fibers of DRN-ERβ+ cells. These findings collectively suggest that DRN-ERβ+ neuronal excitation serves as an inhibitory modulator and is responsible for the decline in receptivity during non-estrus phases.
雌マウスの性的受容性は、主にエストロゲン受容体α(ERα)およびβ(ERβ)に対するエストラジオールの作用によって制御されており、発情周期の日数によって異なる。これまでの研究により、発情日(1日目)におけるロードーシスの誘導には、視床下部腹内側核(VMH)のERαが重要な役割を果たしていることが明らかになっている。しかし、発情翌日(2日目)の非受容状態への移行のメカニズムは、まだ完全に解明されていません。本研究では、背側縫線核(DRN)で高発現しているERβの、屈曲姿勢発現における役割について検討しました。その結果、卵巣を摘出し、エストロゲンとプロゲステロンを投与して発情周期を模倣したERβ-Cre雌マウスにおいて、ERβを発現するDRN(DRN-ERβ+)の神経活動を化学的に抑制すると、2日目に高いレベルのロードーシスが観察された。この結果は、DRN-ERβ+ニューロンの興奮が2日目のロードーシスの減少に必要であることを示唆している。雌雄の行動の相互作用中の光ファイバー測光記録により、雄の挿入に対するDRN-ERβ+ニューロンの活性化は、2日目の方が1日目よりも有意に長引くことが明らかになった。DRN-ERβ+ニューロンを化学遺伝学的に過剰刺激すると、DRN-ERβ+細胞の順行性標識線維が発現していなかったにもかかわらず、ロードーシスの発現を抑制することが知られている脳領域でc-Fosの発現が誘導された。これらの知見は総合的に、DRN-ERβ+ニューロンの興奮が抑制性調節因子として働き、非発情期における受容性の低下の原因となっていることを示唆している。
研究の意義 雌においては、発情周期中に性的に受容可能な状態から非受容期へと切り替わることは、雄との効果的な行動的相互作用と繁殖の成功にとって不可欠である。本研究では、発情当日と発情翌日における、受容行動反応の低下を制御する可能性のある脳領域を明らかにする。その結果、発情当日から翌日にかけての受容行動反応の低下には、中脳背側縫線核のエストロゲン受容体β(ERβ)を発現するニューロンの興奮が重要であることが判明した。これは、もう一つのERであるERαの促進作用とは対照的であり、雌の生殖行動の適応的発現の神経基盤を理解する上で新たな洞察をもたらす。
Abstract 雌マウスの性受容性(ロルドーシス反応)は、主にエストラジオールがエストロゲン受容体α(ERα)とβ(ERβ)に作用することで調節される。本研究では、エストロス周期の受容性状態から非受容性状態への移行において、背側縫線核(DRN)のERβ発現細胞が果たす役割を調査した。ERβ発現DRN(DRN-ERβ+)細胞の活動を化学遺伝学的に抑制したマウスは、通常の非受容性状態への移行が阻害されることが示された。さらに、DRN-ERβ+細胞の興奮がロルドシスを抑制することが示唆された。
背景 雌の性受容性はエストロゲンの作用によって制御され、エストロス周期の特定の日に最も高くなる。本研究では、DRNに高発現するERβが受容性から非受容性への移行に関与している可能性を調査した。
方法 1) 雌マウスのERβ-Cre系統を使用。2) DRN-ERβ+細胞の活動を化学遺伝学的手法で制御。神経活動をファイバーフォトメトリー法で記録。3) 脳領域への投射を同定し、DRN-ERβ+細胞の興奮により誘導されるc-Fos発現を測定。
結果
- DRN-ERβ+細胞の活動抑制: ERβ-iCre雌マウスにおいて、背側縫線核(DRN)でERβを発現する細胞(DRN-ERβ+)の活動を化学遺伝学的手法で抑制したところ、エストロス翌日(Day 2)に通常見られるロルドシス行動の減少が防がれた。具体的には、Week 2においてCNO(クローザピン-N-オキシド)を投与した際、DRN-ERβ+細胞の活動を抑制したグループでは、Day 1と同等のロルドシス指数(LQ)が維持された。一方、Day 1のテストにおいて同様の細胞抑制を行った場合、LQには影響がみられなかった。この結果から、DRN-ERβ+細胞の活動がエストロス翌日におけるロルドシス行動の減少に重要な役割を果たしていることが示唆される。
- DRN-ERβ+細胞の活動促進: 次に、DRN-ERβ+細胞の活動を化学遺伝学的手法で刺激した場合の影響を調べた。CNOによる活動の促進は、エストロス当日(Day 1)におけるロルドシス指数の低下を引き起こした。具体的には、Week 2のテストでDRN-ERβ+細胞を刺激したグループは、コントロールグループと比較して有意に低いLQを示した。しかし、Week 1およびWeek 3でのサライン投与テストでは、両グループ間にLQの差は見られなかった。この結果は、DRN-ERβ+細胞の活動がロルドシス行動の抑制に関与する可能性を示している。
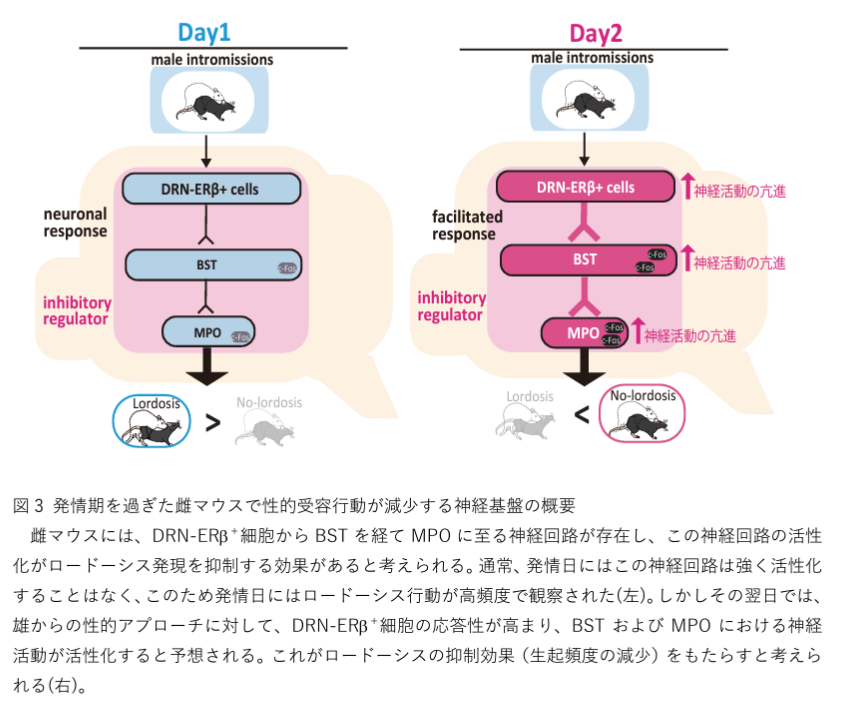
- DRN-ERβ+細胞の活動記録: ファイバーフォトメトリーによる記録では、雌マウスと雄マウスの相互作用中、特に雄による交尾刺激(イントロミッション)に対して、DRN-ERβ+細胞の応答がDay 2で顕著に強いことが明らかになった。Day 1では、雄のイントロミッションに対するDRN-ERβ+細胞の応答は弱く、ほとんどの場合で有意な活動が見られなかった。しかし、Day 2では、特に雌がロルドシス姿勢をとる際にDRN-ERβ+細胞の活動が持続的に増加した。これらの結果は、Day 2におけるDRN-ERβ+細胞の活動がロルドシス行動を抑制するためのネガティブフィードバック回路として機能している可能性を示唆する。
- DRN-ERβ+細胞の投射先: 神経投射の解析では、DRN-ERβ+細胞が多くの脳領域に投射していることが確認されたが、特に視床下部の腹内側核(VMHvl)には弱い信号しか見られなかった。一方、他の性行動の制御に関わる領域である側坐核(LS)、内側視床下部(MPO)、および側坐核(BST)への投射が確認された。これは、DRN-ERβ+細胞が広範な神経ネットワークを介してロルドシス行動を抑制している可能性を示している。
- c-Fos発現の解析: DRN-ERβ+細胞の興奮が特定の脳領域の活動を誘発するかを調べたところ、DRN-ERβ+細胞の化学遺伝学的興奮は視床下部、扁桃体、側坐核などの複数の領域におけるc-Fosの発現増加を誘発した。特に、視床下部腹内側核(VMHvl)および内側視床下部(MPO)でのc-Fos発現が顕著であった。この結果は、DRN-ERβ+細胞の活動が、これらの領域を介してロルドシス行動を抑制する可能性を示唆している。
Discussion
本研究では、DRN-ERβ+細胞の活動がエストロス翌日における性受容性の低下を引き起こす抑制的な役割を果たすことが示唆された。DRN-ERβ+細胞の活動を化学遺伝学的に抑制することで、通常見られるロルドシスの減少が阻止される一方、エストロス当日には活動抑制の効果は観察されなかった。これは、エストロス当日にはDRN-ERβ+細胞の抑制系が活性化されていない、または活動レベルが低いことを示唆している。
さらに、DRN-ERβ+細胞の活動の促進はエストロス当日におけるロルドシス行動の減少を引き起こすことから、DRN-ERβ+細胞が性受容性の調節に関与する抑制系の一部である可能性が示唆された。ファイバーフォトメトリーによる記録から、DRN-ERβ+細胞はエストロス翌日の雄による交尾刺激に対して顕著に応答し、この応答がDay 2におけるロルドシス行動の抑制に関わるネガティブフィードバック回路として機能している可能性が示された。
また、神経投射解析およびc-Fos発現の結果から、DRN-ERβ+細胞が多くの脳領域と広範な神経ネットワークを形成し、特に視床下部や扁桃体を含む性行動の制御に関連する領域において抑制的な信号を送っている可能性が考えられる。これらの知見は、性受容性の神経機構を理解する上で重要であり、さらにヒトにおける性行動の調節や性機能障害のメカニズム解明への応用が期待される。
お隣の研究室からJNSに論文が掲載されました。筆頭著者のMさんは学位審査頑張ってください。
